
 |
 |
 |
 |
 |
|||||||
Plasmodium falciparum
Plasmodium
falciparum (Welch 1897)
D: Erreger der Malaria tropica
E: tropical malaria, malignant malaria
- Systematik
- Kurzer Steckbrief
- Lebenszyklus
- Immunität
- Verbreitung
- Diagnose
- Medizinische Bedeutung
- Medizinische Bedeutung (Schweiz)
- Kontrollmassnahmen
- Web-Informationen
- Literatur
Systematik
top
Stamm:
Apicomplexa (Sporozoa)
Klasse: Haematozoea
Ordnung: Haemosporida
Familie: Plasmodiidae
![]()
Kurzer
Steckbrief
top
Bei
Plasmodium falciparum handelt es sich um den bedeutungsvollsten Einzeller
der Tropen: den Erreger der tödlichen Malaria tropica! Er hat im
Gegensatz zu Giardia einen indirekten Lebenszyklus: Seine Endwirte
sind Stechmücken (Anopheles-Arten) aus der Familie der Culicidae.
Beim Menschen entwickelt sich der Erreger mit ungeschlechtlichen Fortpflanzungszyklen
in der Leber (= exoerythrozytäre Schizogonie) und in den roten Blutkörperchen
(= erythrozytäre Schizogonie). Die Apicomplexa besitzen spezielle
Organellen ("Apikalorgan"), die bei Invasionsprozessen eine
wichtige Rolle spielen, ohne die der komplexe Lebenszyklus nie durchlaufen
werden könnte!

Blutmahlzeit
Lebenszyklus
top
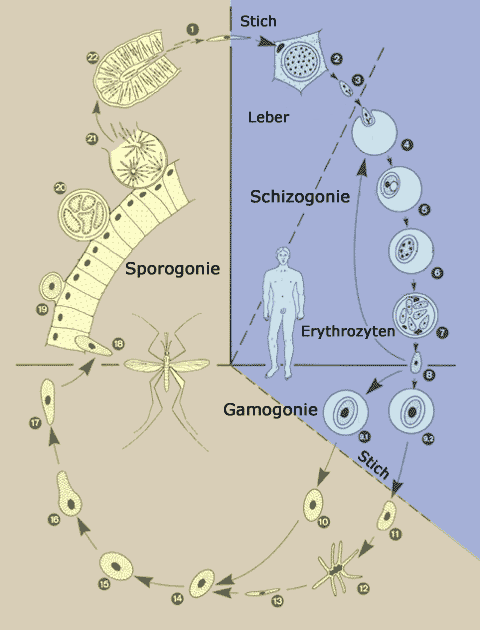
Nach
der Aufnahme von sexuell differenzierten Gamonten, die mit dem Blutmahl
aufgenommen werden, verwandeln sich diese Formen im Darm der Mücke
in Gameten. Nach der Befruchtung des Makrogameten entwickelt sich aus
der Zygote der längliche Ookinet (Grösse: 18 x 3 µm).
Ookineten verlassen das Darmlumen und dringen in das Mitteldarmepithel
ein. Dort beginnt die Sporogonie mit einer Reduktionsteilung. Darauf entwickeln
sich grosse Oozysten an der Darmaussenseite, die bis zu 10'000 (ca. 15 µm
lange) Sporozoiten enthalten. Bricht die Oozyste auf, so gelangen die
Sporozoiten in die Hämolymphe der Mücke. Darauf wird die Speicheldrüse
von den Sporozoiten befallen. Sind Sporozoiten im Speichelausführgang
angelangt, ist die Mücke für den Menschen infektiös geworden.
Dies ist frühestens 8 Tage nach der Infektion der Fall.
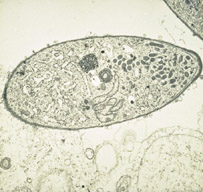
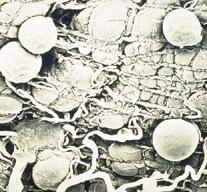


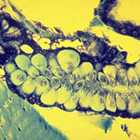
Die
injizierten Sporozoiten befallen nach wenigen Minuten Hepatozyten der
Leber. Dort verwandelt sich der Parasit in eine Gewebsform (Trophozoit),
beginnt mit multiplen Kernteilungen und vergrössert sich zum Leberschizonten
(40-60 µm), der mehrere Tausend Kerne enthalten kann. Darauf
werden aus Kernen und Zytoplasma neue Formen, die Merozoiten, "gebastelt".
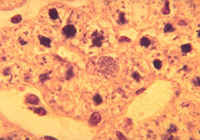
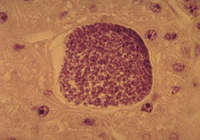
(Fotos S. Bray)
Nach
der Leberschizogonie (bei P. falciparum nur ein Zyklus im Gegensatz zu
anderen Plasmodien-Arten) befallen die Merozoiten rote Blutzellen. Bei
der aktiven Invasion (innert ca. 20 Sekunden) spielen wiederum die apikalen
Organellen eine wichtige Rolle. Die Merozoiten (bei P. falciparum können
auch mehrere pro Wirtszelle eindringen) wandeln sich in junge Trophozoiten,
so genannte Ringstadien, um. Durch Entwicklung und Wachstum entstehen
Schizonten mit 8 bis 32 Kernen. Die rote Blutzelle platzt, dabei kommt
es zu Fieber; die Inkubationszeit beträgt mindestens 9, meist 12-14
Tage, selten auch länger. Es werden Merozoiten ausgeschwemmt, die
wiederum neue Erythrozyten befallen können. Nur Erythrozyten mit
jungen Trophozoiten sind bei der tropischen Malaria — im Gegensatz
zu anderen Malaria-Arten — im peripheren Blut zu finden. Alle Wirtszellen
mit weiter entwickelten Stadien sind wegen der Sequestrierung (Bindung
an Endothelzellen der Blutkapillaren) versteckt und entgehen damit der
Zerstörung in der Milz.
Nach mehreren Wochen der erythrozytären Schizogonie entstehen die
ersten Mikro- und Makrogamonten, welche die infektiösen Stadien für
den Endwirt, die Anophelesmücke, darstellen.
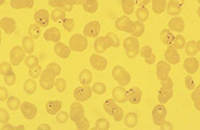
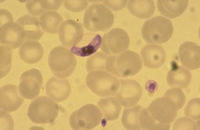
Immunität
top
In
Endemiegebieten baut sich bei angemessener Exposition über Jahre
ein Immunschutz gegen die Malaria auf. Dabei bleibt der Mensch aber infiziert.
Es kommt nicht zu einer "sterilisierenden", sondern zu einer
"klinischen Immunität" oder Prämunität. Die Effektormechanismen,
die dabei eine Rolle spielen, kennen wir trotz intensiver Forschungsarbeit
ebenso wenig wie die auslösenden Antigene.
Auch sind wir den Plasmodien noch nicht auf die Schliche gekommen, wie
sie das Immunsystem erfolgreich austricksen. Eine Rolle spielt sicher
die Antigenvarianz (Antigenwechsel; var Gene) und die Antigendiversität:
Familien von hoch polymorphen Antigenen, die mit verschiedenen variablen
Regionen ausgestattet sind.
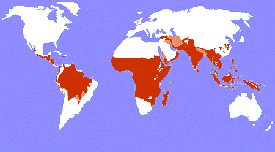
Verbreitung
top
Die
Malaria ist in über 100 Ländern der tropischen und subtropischen
Zonen der Erde endemisch. Die Malaria war noch bis vor 100 Jahren auch
in Europa ein Problem und Plasmodium vivax kam früher sogar am Oberrhein
vor!
Diagnose
top
Die
klassische Methode ist die mikroskopische Untersuchung von peripherem
Blut. Diese setzt gut geschultes Personal voraus! Neuere Methoden erlauben
eine indirekte Diagnose durch den Nachweis von spezifischen Antigenen,
die aber bei schwachen Parasitämien falsch-negativ ausfallen können.
Medizinische
Bedeutung
top
Die
Malaria ist nach Durchfall- und Atemwegserkrankungen die drittwichtigste
Krankheit bezogen auf die Sterblichkeit. Man schätzt, dass jedes
Jahr 300 bis 500 Millionen neue Krankheitsfälle auftreten. Während
sich die Malaria meist als fieberhafte Krankheit mit Schüttelfrost
äussert, kommt es bei wenigen Patienten (1-2% der Fälle) zu
lebensbedrohlichen Zuständen (Koma, Nierenversagen, schwerste Anämie):
über 1 Million Menschen — insbesondere Kleinkinder in Afrika
— sterben jährlich an der Malaria!
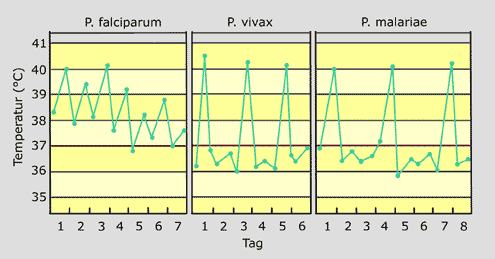
Medizinische
Bedeutung (Schweiz)
top
In
der Schweiz werden jährlich ungefähr 300 importierte Malariafälle
gemeldet. Jedes Jahr sterben ein bis zwei Menschen an der Malaria, weil
die Krankheit zu spät diagnostiziert wird. Eine Seltenheit sind autochthone
Infektionen durch importierte infizierte Stechmücken wie der Malaria-Todesfall
eines Briefträgers in Cointrin im Jahre 1996.
Kontrollmassnahmen
top
In
den 50er Jahren wurde von der Weltgesundheitsbehörde ein Programm
zur Eradikation der Malaria durch den Einsatz von Massenchemotherapie
(Chloroquin) und Insektenbekämpfung (DDT) lanciert. Resistenzentwicklungen
auf der Parasiten- wie auf der Mückenseite führten zusammen
mit finanziellen Problemen zu einem Misserfolg. Heute sprechen wir nicht
mehr von Ausrottung, sondern Kontrolle der Malaria: Ziel ist es, die Häufigkeit
der schweren Krankheitsfälle (Zerebrale Malaria, schwere Anämien)
zu reduzieren. Im Zentrum stehen dabei Massnahmen wie die Expositionsprophylaxe
(vor allem Insektizid-behandelte Mückennetze), eine rasche Diagnose
sowie eine adäquate Therapie.
Die Hoffnung der 70er und 80er Jahre, bald über eine Impfung zu verfügen,
wurde bisher leider nicht erfüllt.
Die wichtigsten prophylaktischen Massnahmen für Tropenreisende bestehen in einer Malaria-Chemosuppression sowie einem adäquaten Expositionsschutz (Repellentien, Kleider etc.).
Die Resistenzentwicklung gegen Chloroquin begann 1957. Heute sind resistente Plasmodien in vielen Malariagebieten ein grosses Problem. Die Entwicklung der Resistenz in den letzten 40 Jahren zeigt folgende Animation:
Web-Informationen
(Stand März 2003)
top
http://www.cdfound.to.it/HTML/pla1.htm
(Bilder im Atlas of Medical Parasitology der Carlo Denegri Foundation)
http://www.wehi.edu.au/MalDB-www/who.html
(Malaria Database; molekulare Infos zu Genom und Proteinen)
http://www.malaria.org/
(Malaria Foundation; Globale Initiativen zur Bekämpfung)
Literatur
top
Monographie:
"Essential Malariology" 3rd ed., eds. H.M. Gilles & D.A.
Warrell; Edward Arnold London, 1993 (in STI Bibliothek)
Marsh
K. (1992): Malaria - a neglected disease? Parasitology 104, S. 53-S. 69.
Nchinda T.C. (1998): Malaria: A reemerging disease in Africa. Emerging
Infectious Diseases 4, 398-403.
Miller L.H. et al. (1994): Malaria Pathogenesis. Science 264, 1878-1883.
Coppel R.L. et al. (1998): Adhesive proteins of the malaria parasite.
Current Opinion in Microbiology 1, 472-481.
