Leishmania tropica, L. major
Stamm:
Sarcomastigophora
Klasse: Zoomastigophorea
Ordnung: Kinetoplastida
Familie: Trypanosomatidae
D:
Erreger der kutanen Leishmaniose
E: cutaneous Leishmaniasis
F: Leishmaniose cutanée
1.
Parasit, Übertragung und Vorkommen
2. Diagnostik
3. Wirt-Parasitinteraktion
4. Infektion und Krankheit
5. Epidemiologie
6. Kontrollstrategien
7. Kernsätze
8. Ressourcen
1.
Parasit, Lebenszyklus und Verbreitung
top
1. 1. Parasit
Leishmanien sind Einzeller, die durch Schmetterlings- oder Sandmücken (Phlebotomen der Familie Psychodidae) übertragen werden. Ihr Hauptverbreitungsgebiet liegt in den Tropen und Subtropen. Dort sind sie Verursacher zahlreicher Erkrankungen wie Viszerale Leishmaniose (Kala-Azar), kutane Leishmaniose (Orientbeule) sowie Haut- und Schleimhautleishmaniosen ("Chiclero's Disease", "Espundia"). Die verschiedenen humanpathogenen Arten und Unterarten (über 10 beim Menschen) sind morphologisch nicht unterscheidbar. Wir beschränken uns auf die Erreger der kutanen Leishmaniose in der Alten Welt.
|
Erreger |
Krankheitsbild |
Wirte |
Vektor |
Vorkommen |
|
L. tropica |
Kutane Leishmaniose |
Nur Mensch |
Phlebotomus spp. |
Mittelmeerraum, Südwestasien (Indien) |
|
L. major |
Kutane Leishmaniose |
Zoonose |
Phlebotomus spp. |
Nordafrika, Sahelzone, Mittlerer Osten, Westasien |
|
L. aethiopica |
Kutane und diffuse kutane Leishmaniose |
Zoonose |
Phlebotomus spp. |
Sehr
lokal in Afrika |
Anmerkung:
Die systematische Einteilung nach klinischen Kriterien wird heute durch
die Genotypisierung der Leishmanien abgelöst. So können sich
beispielsweise "kutane Leishmanien" unter Umständen auf
andere Gewebe ausbreiten. Ursache dafür ist in vielen Fällen
eine nicht adäquate Immunantwort des Wirtes, wie sie bei HIV-Infektionen
vorkommt. Der Immunstatus des Wirtes hat also entscheidenden Einfluss
auf das klinische Bild.
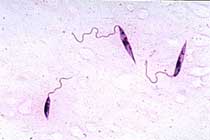


Promastigote Stadien von Leishmania donovani; WHO, TDR, Stammers
Stich einer weiblichen Schmetterlingsmücke; Royal Tropical Institute, Amsterdam
Phlebotomus dubosci beim Blutmahl; WHO, TDR, Stammers
1.2. Lebenszyklus
Leishmanien werden durch weibliche Schmetterlingsmücken (Familie Psychodidae) der Gattungen Phlebotomus (Asien und Afrika) sowie Lutzomyia (Mittel- und Südamerika) übertragen. Die Übertragung erfolgt durch den Stich einer infizierten Mücke bei der Blutmahlzeit. Die promastigoten Stadien werden von Phagozyten wie beispielsweise Makrophagen, dendritische Zellen oder Langerhans-Zellen aufgenommen. Dort werden sie nicht zerstört, sondern wandeln sich in amastigote Formen um. Diese vermehren sich in der parasitophoren Vakuole durch Zweiteilung, bis die Wirtszelle schliesslich platzt. Die freigewordenen Amastigoten werden entweder erneut von Phagozyten phagozytiert oder von einem geeigneten Vektor aufgenommen. Ebenso können infizierte zirkulierende Makrophagen vom Vektor aufgenommen werden. Im Darm der Schmetterlingsmücke wandeln sie sich zu promastigoten, begeisselten Stadien um, die sich durch Zweiteilung stark vermehren. Schliesslich sind Vorderdarm und Stechrüssel der Mücke mit Promastigoten angefüllt, die beim nächsten Blutmahl in einen Wirt übertragen werden.
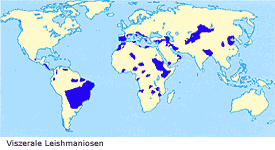
1.3. Verbreitung
Die Leishmaniosen
sind in über 88 Ländern der Tropen und Subtropen verbreitet. Darüber
hinaus kommen sie auch im Mittelmeerraum und in Mittelasien vor, während
Australien frei von Leishmanien ist. Die WHO schätzt, dass weltweit etwa
12 Mio. Menschen mit den Erregern infiziert sind, jährlich kommen etwa
2 Mio. Neuerkrankungen dazu.
Die Verbreitung der Leishmaniose ist streng an das Vorkommen ihrer Vektoren,
der Schmetterlingsmücken, gebunden.
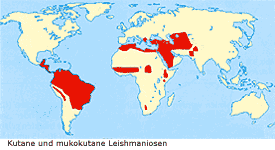
Die kutanen Leishmaniosen der Alten Welt sind in Europa (Mittelmeerländer),
in Afrika (Nordafrika, Sahel) und in Asien (Kleinasien, Mittlerer Osten, Südwestasien)
verbreitet.
2.
Diagnostik
top
Die Diagnose der kutanen Leishmaniose wird durch die Hautsymptomatik erleichtert.
Der endgültige Erregernachweis geschieht mittels Kultur. Dazu wird
eine Gewebeprobe aus dem Randbezirk des Hautgeschwürs entnommen und
die Erreger in speziellem Kulturmedium nach 3-10 Tagen mikroskopisch als
promastigote Kulturformen nachgewiesen. Heute lassen sich Leishmanien
durch den Nachweis ihrer DNS mittels Hybridisierung (Dot Blot) oder Polymeraseketten-Reaktion
(PCR) direkt ab Hautbiopsie schneller nachweisen.
Für den Erregernachweis bei einer viszeralen Leishmaniose müssen
Lymphknoten oder Knochenmark punktiert werden. Da diese Verfahren invasiv
sind, wird meist die Serologie – der Nachweis spezifischer Antikörper
– zur Abklärung vorgezogen, die bei der kutanen Leishmaniose
aber keine diagnostische Bedeutung hat.
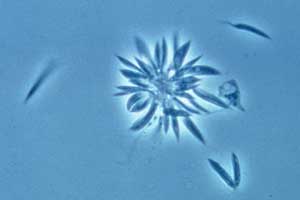
Promastigote und geklumpte amastigote Leishmanien in Kultur; WHO
3.
Wirt-Parasitinteraktionen
top
Spezifische Aspekte in der Übersicht:
3.1
Wirtsmoleküle vermitteln die Aufnahme des Parasiten in Phagozyten
3.2 Wie können Leishmanien in Makrophagen überleben?
3.3 Die Immunantwort bestimmt den Verlauf der kutanen Leishmaniose
3.4 Der Lebenszyklus des Parasiten im Vektor
3.1
Wirtsmoleküle vermitteln die Aufnahme des Parasiten in Phagozyten
Die Oberfläche der infektiösen promastigoten Formen („metazyklische
Formen“) sind mit einer komplexen Glykokalyx umgeben, die neben
Phospholipiden vor allem aus Lipophosphoglykanen (LPG) und gp63, einer
Metalloprotease („Leishmanolysin“) aufgebaut wird. Diese Moleküle
interagieren mit Komplement. Es kommt zur Anlagerung von C3b, welches
als Ligand zu den Komplementrezeptoren (CR1 und CR3) auf der Makrophagen-Oberfläche
wirkt. Daneben kann gp63 auch mit dem Mannose/Fukose-Rezeptor der Wirtszellen
direkt binden. Damit wird die Phagozytose induziert. Bei den aufgenommenen
Leishmanien ist die Geissel reduziert. Damit ist aus einer extrazellulären
promastigoten eine intrazelluläre amastigote Form entstanden. Die
beiden Formen unterscheiden sich aber nicht nur morphologisch. Dieser
Wechsel verändert die Zellphysiologie drastisch (Art des Metabolismus
(aerob zu anaerob); Temperaturoptimum u.a.).
3.2
Wie können Leishmanien in Makrophagen überleben?
Dass ein Parasit in einer professionellen Abwehrzelle des Wirtes heimisch
wird, die auf die Zerstörung von Pathogenen spezialisiert ist, mag
doch erstaunen. Die Interaktionen zwischen Parasit und Wirtszelle („cross
talk“) sind äusserst komplex und werden erst in Ansätzen
verstanden. Zum einen führt die Phagozytose über Komplementrezeptoren
(sog. Phagozytose-Typ II) nicht zu einer Makrophagenaktivierung, wie dies
auch bei Mycobacterium nachgewiesen werden konnte. Nach Lehrbuchmeinung
sind Leishmanien gegenüber lysosomalen Enzymen resistent. Neuere
Arbeiten mit konfokaler Mikroskopie scheinen ein Entweichen von Leishmanien
aus dem Phagosom in das Zytosol zu belegen, wie dies von anderen Pathogenen
(z.B. Trypanosoma cruzi, dem Erreger der Chagas Krankheit) schon nachgewiesen
ist.
Sicher ist, dass ein Makrophage durch eine Leishmanien-Infektion sowohl
in seiner Physiologie wie auch als Effektorzelle komplett verändert
wird: Seine Zytokinproduktion wird auf anti-inflammatorische Zytokine
(wie IL-10 und TGF-beta) umgestellt. Die IL-12 Produktion wird eingestellt,
und damit wird verhindert, dass NK-Zellen oder TH1-Zellen IFN-gamma produzieren.
Dies ist deshalb wichtig, weil IFN-gamma die induzierbare NO (Stickoxid)-Synthetase
anregen kann. Eine NO-Produktion ist für Leishmanien absolut tödlich!
Ebenfalls wird die Antigenprozessierung und –präsentation verringert
und somit eine T-Zell Stimulation verhindert.
3.3
Die Immunantwort bestimmt den Verlauf der kutanen Leishmaniose
Unsere Kenntnisse stammen in erster Linie von einem Labormodell (L.
major und infizierte Inzuchtmäuse), das den Immunologen grundlegende
T-Zellmechanismen offenbart hat. Bei so genannten resistenten Inzuchtstämmen
(wie etwa bei C57BL oder CBA) bildet sich die Hautläsion nach 2 bis
3 Wochen zurück. Im Gegensatz dazu werden empfängliche
Mausstämme (z.B. Balb/c) schwer krank und vermögen die Infektion
nicht unter Kontrolle zu halten. Allerdings – das haben Übertragungsversuche
gezeigt – wird bei den resistenten Mausstämmen keine sterile
Immunität erreicht: Es handelt sich um eine „klinische Immunität“.
Auch beim Menschen wird – im Gegensatz zu den Angaben in älteren
Lehrbüchern – eine klinische Immunität aufgebaut. Eine
Immundefizienz (z.B. HIV-Infektion) kann eine klinisch inapparente Leishmaniose
reaktivieren!
Um eine Leishmanien-Infektion unter Kontrolle zu halten, d.h. um die intrazellulären
Parasiten abzutöten, müssen die befallenen Wirtszellen aktiviert
werden: Für die Makrophagenaktivierung sind aktivierte T-Helfer 1
(TH1)-Zellen entscheidend: Interferon (IFN)-gamma Signal und ein zweites
Signal (Korezeptorbindung) induzieren die NO-Synthetase der Makrophagen.
Stickoxid (NO) ist für die intrazellulären Parasiten tödlich.
Für die Entwicklung und Erhaltung einer TH1-Immunantwort ist das
Zytokin IL-12 (das überdies eine TH2-Antwort verhindert) unabdingbar.
Es ist also eine überwiegende TH1-Immunantwort, welche resistente
Mäuse wie auch Menschen vor einer krankmachenden Leishmaniose schützt.
Die Empfänglichkeit der Balb/c-Mäuse ist durch eine überschiessende
TH2-Immunantwort bedingt, die kurz nach der Infektion einsetzt und durch
IL-4 und IL-10 aufrechterhalten wird. Die durch eine TH2-Immunantwort
stimulierten Antikörper spielen keine Rolle bei der Elimination des
intrazellulären Parasiten.
3.4
Der Lebenszyklus des Parasiten im Vektor
Werden amastigote Formen vom Vektor mit dem Blutmahl aufgenommen, so differenzieren
diese im Darm innert 12 bis 24 Stunden zu prozyklischen Promastigoten mit
kurzer Geissel. Diese Morphogenese spielt sich auch in einer Kultur im Nährmedium
ab. Nach weiteren 3 Tagen entstehen lange schlanke Formen mit einer langen
Geissel (sog. nectomonade Formen). Diese heften sich an das Darmepithel an
und proliferieren. Die Adhärenz über Seitenketten der Lipophosphoglykane
(LPG) an Lektinrezeptoren der Darmwand verhindert die Exkretion der Parasiten
mit den Rückständen des Blutmahls. Frühestens 7 Tage nach der
Infektion sammeln sich infektiöse metazyklischen Formen im vorderen Darmabschnitt
(Stomodeum). Ihre LPGs unterscheiden sich von denjenigen der nectomonaden
Formen: Ihre Seitenketten sind länger. Damit wird eine Komplementresistenz
erreicht. Der Membran-attackierende Komplex kann nicht wirksam werden. Durch
Erbrechen gelangen promastigote Leishmanien beim Blutmahl in den nächsten
Wirt.
4.
Infektion und Krankheit
top
Die
verschiedenen Formen der Leishmaniose haben vor allem in den tropischen
und subtropischen Ländern der Erde eine Bedeutung. Insgesamt sind
weltweit mindestens 12 Mio. Menschen mit Leishmanien infiziert. Die WHO
geht davon aus, dass jährlich etwa 2 Mio. Neuerkrankungen dazu kommen.
Da die Leishmanien Zellen wie Makrophagen besiedeln, können sie nur
über eine zellvermittelte Immunantwort des Körpers, das heisst
über eine Aktivierung von Th1-Zellen bekämpft werden. Da beispielsweise
HIV-Infizierte zuwenig funktionsfähige T-Helferzellen haben, verläuft
bei diesen Patienten eine Infektion mit Leishmanien oft fatal. Ausserdem
ist es möglich, dass bei AIDS-Patienten eine klinisch latente Infektion
mit Leishmanien ausbricht. Typische Befunde sind Knoten und Ulzera auf
der Zunge, im Ösophagus, Larynx, Magen, Rektum und der Lunge. Mit
der weltweiten Zunahme der AIDS-Fälle hat so auch die Leishmaniose
als HIV-assoziierte Infektion eine neue Bedeutung bekommen.
Auch immunkompetente Patienten können schwer erkranken. Während
bei den mukokutanen und kutanen Leishmaniosen entstellende Ulzera mit
zum Teil erheblichen Gewebedestruktionen auftreten, endet eine unbehandelte
viszerale Leishmaniose (Kala-Azar) meist tödlich. Erschwerend kommt
hinzu, dass es bis heute keine Chemoprohylaxe und keinen Impfstoff gibt.
Ausserdem zeichnen sich die vorhandenen Chemotherapeutika — meist
Antimonpräparate — durch viele Nebenwirkungen aus.
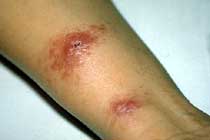
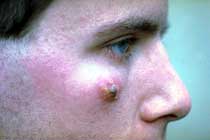
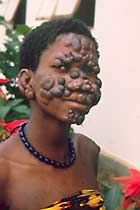
Kutane Leishmaniose bei einer Thaifrau, selten in Südostasien; Ch. Hatz, STI
Kutane Leishmaniose: Orientbeule; STI
Die kutane Leishmaniose kann einer lepromatösen Lepra ähneln, Tabora, Tansania; Laufer
5.
Epidemiologie
top
Zoonose:
Eine Zoonose liegt laut Definition der WHO dann vor, wenn ein Erreger
vom Wirbeltier auf den Menschen, gelegentlich auch umgekehrt, übertragen
wird. Dies trifft auch für die Leishmaniose zu. Neben dem Menschen
gibt es in vielen Regionen der Erde auch ein Erregerreservoir unter Wild-
und Haustieren. Dazu zählen wildlebende Nagetiere, bei der viszeralen
Leishmaniose aber auch Karnivoren wie Hunde, die selbst schwer an Leishmaniose
erkranken.

Psammomys obesus - ein Nagetier - ist ein natürliches Reservoir für Leishmania; Isfahan, Iran; WHO/TDR/Crump
6.
Kontrollstrategien
top
Prophylaxe
Gegen die Leishmaniose gibt es bisher keine wirksame Chemoprophylaxe.
Deshalb ist die Expositionsprophylaxe entscheidend. Wirksam sind nur engmaschige,
mit Insektiziden imprägnierte Moskitonetze.
Vektorkontrolle
Eine weitere Möglichkeit ist die Bekämpfung der Überträger.
Dies geschieht durch den Einsatz von Insektiziden und die Beseitigung
von Brutstätten. Aufgrund kurzer Flugdistanzen und hoher Empfindlichkeit
gegenüber Insektiziden ist eine periodische Bekämpfung der Schmetterlingsmücken
gerade in Städten sinnvoll.
Therapie
Bei einer kutanen Leishmaniose, die spontan abheilt, ist eine Therapie –
ausser bei der disseminierten Form – nicht nötig. Als Chemotherapeutika
gegen viszerale Leishmaniosen werden Antimonpräparate (Glucantime oder
Pentostam) verwendet, welche jedoch schlecht verträglich sind. Neue Präparate
sind liposomales Amphotericin B und als neuestes Medikament Miltefosine, das
oral eingenommen werden kann.
Impfung
Die selbst heilende kutane Leishmaniose (Orientbeule) hinterlässt
Narben. Die früher praktizierte Form einer Inokulation mit Ulkusmaterial
an einer nicht auf Anhieb sichtbaren Stelle wird heute meist nicht mehr
durchgeführt, da dadurch eine latente Infektion gesetzt werden kann.
Obwohl einige Impfversuche mit mässigem Erfolg stattgefunden haben,
gibt es derzeit keinen zuverlässigen Impfstoff gegen Leishmaniosen.


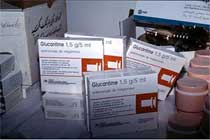
Prophylaxe: Ein engmaschiges Netz als Schutz vor Schmetterlingsmücken; WHO
Therapie: Antimonpräparate (Glucantime) gegen Leishmaniose; WHO
Vektorkontrolle: Einsatz von Insektiziden gegen Schmetterlingsmücken; WHO
7.
Kernsätze
top
- Leishmanien sind begeisselte Einzeller, die von Schmetterlingsmücken übertragen werden. Neben dem Menschen kann für die meisten Arten ein tierisches Reservoir (= Zoonose) bestehen. Dies gilt nicht für L. donovani und L. tropica.
- Der Parasit hat zwei Haupterscheinungsformen: begeisselte extrazelluläre promastigote Formen im Darm des Vektors und die intrazelluläre nicht-begeisselte amastigote Form in Wirtszellen.
- Bei der Blutmahlzeit des Vektors übertragene Promastigote nutzen angeborene Wirtsabwehrstrategien um rasch in ihre Wirtszellen zu gelangen.
- Amastigote haben verschiedene Überlebensstrategien, um in den Abwehrzellen zu überleben: Veränderungen der Wirtszellphysiologie, Resistenz gegen lysosomale Enzyme und eventuell entweichen in das Zytosol.
- Eine protektive Wirtsabwehr wird durch eine TH1-Immunantwort realisiert.
- Die beobachtete Immunität nach einer kutanen Leishmaniose ist keine sterile, sondern eine klinische Immunität. Eine HIV-Infektion oder eine andere Form der Immunsupprimierung führt zu einer Reaktivierung einer latenten Infektion.
8.
Ressourcen
top
Lehrbuch
“Medizinische Mikrobiologie” (10. Auflage), Kayser et al.,
Thieme-Verlag: Leishmania (Seiten 510 bis 517)
Lernprogramm "Leishmaniasis" auf Englisch (Topics in International
Health, The Wellcome Trust)