Neisseria
meningitidis
(Meningokokken)
Neisseria
meningitidis (Albrecht und Ghon, 1901)
Aerobe, gramnegative Diplokokken
Familie: Neisseriaceae
Gattung: Neisseria
D: Meningokokken
E: meningococci
F: méningite méningococcique
1.
Parasit, Übertragung und Vorkommen
2. Diagnostik
3. Wirt-Parasitinteraktion
4. Infektion und Krankheit
5. Epidemiologie
6. Kontrollstrategien
7. Kernsätze
8. Ressourcen
1.
Parasit, Übertragung und Vorkommen
top
1.1. Parasit
Neisserien sind gramnegative, semmelförmige Diplokokken (Grösse
0.2 bis 0.8 µm). Von medizinischem Interesse sind N. gonorrhoeae
(Erreger der Gonorrhö) und N. meningitidis. Darüber hinaus gibt
es viele apathogene Neisserienarten, die zur Normalflora des Rachenraums
gehören. Die Artdifferenzierung erfolgt unter anderem auf Grund der
unterschiedlichen Fähigkeiten Zucker zu spalten.
N. meningitidis wächst auf bluthaltigen Medien, Kohlendioxid fördert
das Wachstum.
Auf Grund unterschiedlicher Kapsel-Polysaccharide lassen sich N. meningitidis
Stämme serologisch in verschiedene Gruppen (u.a. A, B, C, W135, Y)
einteilen.
Das Genom von Meningokokken der Serogruppen A und B wurde im Jahre 2000
vollständig sequenziert. Die Genomgrösse beträgt 2.2 Millionen
Basenpaare. Ein horizontaler DNS-Austausch wurde zwischen Neisserien und
andern Bakterien nachgewiesen (Akquisition von Virulenzfaktoren!).
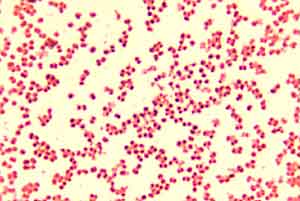
Neisseria meningitidis in Kultur; Y. Endriss
Meningokokken sind auf den Menschen beschränkt. Das natürliche Habitat dieser Bakterien ist der Nasopharynx. Die Übertragung der Keime von Mensch zu Mensch erfolgt vermutlich durch Inhalation von Tröpfchen von infiziertem nasopharyngealem Sekret und durch direkten oder indirekten oralen Kontakt.
Meningokokkenerkrankungen sind ein weltweites Problem, einerseits sporadisch auftretend, andererseits als lokalisierte Ausbrüche, weitreichende Epidemien oder als Pandemien.
In den industrialisierten Ländern liegt die jährliche Inzidenz an Meningokokkeninfektionen allgemein bei 1 bis 10 Fällen pro 100 000 Einwohnern. Bei Kindern unter dem 2. Lebensjahr liegt sie allerdings höher. In der Schweiz werden im Jahr etwa 200 Fälle von Meningokokken Meningitis registriert, 15 davon mit tödlichem Ausgang.
Grosse Ausbrüche von Meningokokkenerkrankungen werden regelmässig aus Afrika, China und Südamerika berichtet. Diese Epidemien können Tausende Menschen betreffen und viele Todesfälle verursachen. Meningokokken der Serogruppe A und C sind die primäre Ursache dieser Epidemien.
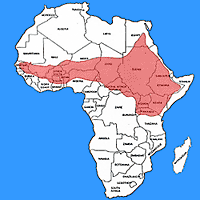
Der Meningitisgürtel in Afrika
Meningitis-Fall
in Sittener Gymnasium
Ein Schüler des Gymnasiums von Sitten ist in der Nacht auf den Donnerstag
wegen einer Meningokokken-Meningitis ins Spital eingeliefert worden. Die Mitschülerinnen
und -schüler aus seiner Klasse wurden vorsorglich mit Antibiotika behandelt.
Der Fall war der Schule vom Kantonsarzt am Donnerstagmorgen mitgeteilt worden,
wie dieser auf Anfrage sagte. Im Laufe des Nachmittags wurden alle Schüler
über die Situation informiert. Offenbar handelt es sich um einen isolierten
Fall. (sda)
NZZ vom 31. August 2001, 02:17
2.
Diagnostik
top
Neisseria meningitidis wird in Liquor, Nasen- und Rachenabstrichen sowie im Blut nachgewiesen. Das Untersuchungsmaterial muss rasch verarbeitet werden, da die Erreger kälteempfindlich sind. Im Ausstrich sind gramnegative Diplokokken intra- und extrazellulär sichtbar. Neisserien lassen sich auf komplexen Medien wie Kochblutagar anzüchten. Eine Abgrenzung zu anderen Neisserien erfolgt biochemisch. Im Liquor können Antigene von Meningokokken über einen Latex-Agglutinationstest direkt nachgewiesen werden.
Einschub
Gramfärbung:
Objektträger trocknen lassen
Fixieren des Bakterienausstriches: Objektträger kurz durch Brennerflamme
ziehen
Färben mit Carbolgentianaviolettlösung für 2 min.: wenige
Tropfen Farblösung auf den Objektträger geben; bitte auf der
Färbebank arbeiten!
Abgiessen der Farblösung (Nicht nachspülen!)
Übertragen in Lugol’sche Lösung für 2 min.
Abgiessen der Lösung
Differenzieren in 96%igem Alkohol bis sich keine Farbwolken mehr bilden
Färben mit Carbolfuchsin für 20 sec.
Kurz in Wasser spülen und danach trocknen
Auswerten im Mikroskop (100er Objektiv/Öl):
Färbeergebnis:
gram-positive Bakterien: schwarzblau
gram-negative Bakterien: rötlich, hell


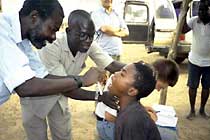
oben: Entnahme von Zerebrospinalflüssigkeit bei einem Kind in Navrongo, Ghana; G. Pluschke. rechts: Schema der Entnahme von Cerebrospinalflüssigkeit.
Rachenabstrich in Navrongo, Ghana; G. Pluschke
3.
Wirt-Parasitinteraktionen
top
Spezifische Aspekte im Überblick:
3.1 Kolonisierung des Nasen-Rachenraumes
3.2 Invasion des Nasopharynx-Epithels
3.3 Die Kapsel als Schutz vor der Phagozytose
3.4 Übertritt der Meningokokken vom Blut ins Gehirn
3.5 Bakterielle Endotoxine können einen Menschen in 24 Stunden töten
3.6. Immunität gegen Meningokokken
3.1
Kolonisierung des Nasen-Rachenraumes
Durch Tröpfcheninfektion gelangt der Erreger in den Nasopharynx-Raum.
Durch Haftpili auf seiner Oberfläche kann sich der Erreger an das
Schleimhautepithel anhaften. Dabei spielen äussere Membranproteine
(u.a.Opa, Opc) eine besondere Rolle. Die Schleimhautepithelien bilden
also eine natürliche Barriere gegen das Eindringen ins Körperinnere.
Sezernierte IgA-Proteasen helfen den Bakterien zu überleben, inhibieren
sie doch die Wirkung protektiver Antikörper.
3.2
Invasion des Nasopharynx-Epithels
Was den Ausschlag gibt, dass Meningokokken eine invasive Erkrankung hervorrufen,
ist noch nicht vollständig geklärt, hängt aber hauptsächlich
von Wirtsfaktoren ab. Sicher spielen auch "Phasenvariation"
(Ein- und Ausschalten bestimmter Gene) und Antigenvarianz (von Oberflächenmolekülen)
eine wichtige Rolle, die zu schlagartigen Änderungen des Phänotyps
führen kann.
Eine invasive Meningokokkenerkrankung bildet sich fast ausschliesslich
bei Menschen, denen schützende, bakterizide, gegen den infektiösen
Stamm gerichtete Antikörper fehlen.
Bei Kindern in den ersten Lebensmonaten spielen passiv übertragene
maternale Antikörper bei der Protektion eine Rolle. Mit dem Verlust
der maternalen Antikörper steigt die Anfälligkeit für eine
Infektion mit einem Gipfel im Alter von 6 bis 12 Monaten. Sie fällt
danach zunehmend ab, da vermutlich durch die Besiedlung mit eng verwandten,
nicht-pathogenen Bakterien wie N. lactamica, mit avirulenten N. meningitidis
oder mit anderen Bakterien, die Oberflächenantigene exprimieren,
die mit denen von virulenten Meningokokkenstämmen kreuzreagieren.
3.3
Übertritt der Meningokokken vom Blut ins Gehirn
In manchen Fällen bleiben die Meningokokken auf das Blut beschränkt,
d.h. es entwickelt sich keine Entzündung der Hirnhäute. Für
ein Überleben im Blut ist der Besitz einer Kapsel unumgänglich.
Die Vermehrung der Meningokokken im Blut (Sepsis; "Blutvergiftung")
ist ebenfalls lebensbedrohlich. Die Kliniker bezeichnen diese Erkrankung
als Waterhouse-Friderichsen-Syndrom. Wie Meningokokken die Blut-Hirnschranke
überwinden ist heute noch ungeklärt.
3.4
Die Kapsel als Schutz vor der Phagozytose
Durch die Beschaffenheit der Kapseloberfläche wird die Enstehung
einer funktionellen Konvertase und des Membran-Attacke-Komplexes verhindert.
Dadurch wird eine effiziente C3b-vermittelte Opsonierung unmöglich
gemacht.
Meningokokken der Gruppen A und C induzieren Antikörper gegen ihre
Kapsel-Polysacharide, welche die Bakterien opsonisieren und durch Phagozytose
und/oder Komplement-abhängige Lyse eliminieren.
Meningokokken der Gruppe B hingegen besitzen ein wirtsähnliches Kapsel-Polysaccharid
(ein Sialinsäure-Homopolymer). Dieses antigene Mimikry hat zur Folge,
dass die Kapsel vom Immunsystem nicht erkannt wird.
3.5
Bakterielle Endotoxine können einen Menschen in 24 Stunden töten
Meningokokken, die in das Blut vorgedrungen sind, vermehren sich rasend
und dringen in den Zerebrospinalraum ein. Bei den Teilungsprozessen werden
Endotoxine frei. Bei diesen Toxinen handelt es sich um toxische Zellwandkomponenten,
wie Lipopolysaccharid (LPS) und andere. Durch diese Endotoxine werden
Makrophagen aktiviert, die TNF-alpha ausschütten. Das wiederum hat
systemisch pleiotrope Wirkungen: es verursacht Fieber, entzündet
die Gefäßwände, stört das Gerinnungssystem und führt
zu Blutungen.
3.6.
Immunität gegen Meningokokken
Immundefizite bei infizierten Menschen haben zum Verständnis der
Immunabwehr bei endemisch auftretenden Meningokokken-Erkrankungen beigetragen.
Für die natürliche Immunität gegen Meningokokken könnte
die Besiedelung mit nicht-pathogenen N. lactamica und nicht-verwandten,
aber immunologisch ähnlichen Bakterien wichtig sein.
Das Komplementsystem und Antikörper gegen die Kapsel (bei B Meningokokken
auch gegen Membranproteine) spielen eine kritische Rolle in der Immunabwehr
der invasiven Meningokokkenerkrankung, da aktiviertes Komplement durch
direkte Lyse oder durch Opsonierung und Phagozytose zum Tod der Bakterien
führt. Individuen, die rezidivierende Attacken mit Neisserien-Infektionen
durchmachen, haben eine hohe Prävalenz familiärer Defizite terminaler
Komplementfaktoren. Dieses Defizit resultiert in der Unfähigkeit,
den Membrane-Attacking-Complex (C5-C9) zu bilden. Die Prävalenz an
terminalem Komplementfaktoren-Defizit in der Gesamtbevölkerung ist
sehr gering (etwa 0,03%), aber ungefähr 50% aller betroffenen Individuen
machen irgendwann eine Meningokokkeninfektion durch. Bei diesen Menschen
verlaufen die Infektionen gewöhnlich mild und die Mortalität
ist gering. Patienten mit Komplementfaktoren-Defizit tendieren zu Infektionen
mit den selteneren Serogruppen W-135, X, Y, Z und 29E.
Individuen mit Properdin-Defizit, einer geschlechtsbezogenen vererbten
Störung, haben eine funktionierende klassische Komplementaktivierung,
aber eine gestörte alternative Aktivierung. Mehr als die Hälfte
der Männer dieser Gruppe entwickelt eine Meningokokkenerkrankung,
wobei der Verlauf häufig fulminant ist mit einem tödlichen Ausgang
in annähernd 75%. Eine Vakzination von properdindefizienten Menschen
reduziert wahrscheinlich das Risiko für eine Meningokokkenerkrankung,
da die Bildung von komplementbindenden Antikörpern über den
klassischen Weg zur Komplementaktivierung und zur nachfolgenden Lyse sowie
Opsonierung und Phagozytose der Bakterien führt. Individuen mit Hypogammaglobulinämie,
primär isoliertem IgM-Defizit oder funktioneller Asplenie haben ebenso
ein erhöhtes Risiko für sporadische Meningokokkenerkrankung,
obgleich Pneumokokkeninfektionen in dieser Gruppe viel häufiger sind.
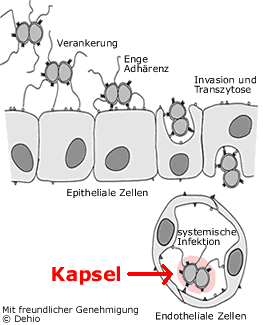
Eine
erste Interaktion zwischen Neisserien und dem Epithel wird durch die Pili
gewährleistet. Darauf interagieren verschiedene Membranproteine der Neisserien
(Opa, Opc u.a.) mit Adhäsinen (u.a. Integrinen) auf der Epitheloberfläche.
Dadurch wird die Kolonisation gewährleistet.
Noch nicht abschliessend geklärt ist wie die Epithelbarriere überwunden
wird (evt. durch Transzytose).
Meningokokken im Blut besitzen eine Kapsel, welche die Serumresistenz sichert.
Die primäre Adhärenz an Epithelzellen erfolgt wahrscheinlich über Pili. Das Bakterium kann dann einen engen Kontakt zur Wirtszelle über Opa-Proteine herstellen. Diese Interaktion könnte den Bakterien die Passage durch die Zelle ins subepitheliale Gewebe ermöglichen. Pilus- oder Opa-vermittelte Interaktionen zwischen den Bakterien und professionellen Phagozyten wie Granulozyten und/oder Monozyten führen zu einer Opsonin-unabhängigen Aufnahme der Bakterien. Die Interaktionen zwischen Neisserien und dem Endothel könnte dazu führen, dass die Bakterien in den Blutstrom gelangen, wo sie sich systemisch ausbreiten können. Faktoren wie die Ausbildung einer Kapsel oder die Sialisierung von Lipopolysacchariden führen dazu, dass integrale äussere Membranproteine wie Opa maskiert werden. Dadurch werden die Bakterien im Serum schlecht erkannt und sind so zum Teil resistent gegenüber Angriffen der Immunabwehr.
4.
Infektion und Krankheit
top
Besiedlung und Invasion
Eine Meningokokkeninfektion beginnt im Nasopharynx. Nach der Anhaftung
an der nasopharyngealen Schleimhaut (Pili) durchqueren die Meningokokken
die Epithelzellen des Nasopharynx. Dies geschieht eventuell durch Transzytose
oder könnte durch Schleimhautschädigungen – bedingt durch
andere Pathogene – unterstützt werden.
Innerhalb von 24 h werden die Mikroorganismen in der Submucosa in der
Nähe von lokalen Immunzellen und Gefässen beobachtet. In den
meisten Fällen verläuft diese nasopharyngeale Infektion subklinisch,
gelegentlich können sich milde Symptome entwickeln.
Nach der Schleimhautpenetration und vermutlich in einer Phase der Adaptation
(Ausbildung der Kapsel) kann das Bakterium Zugang zum Blutkreislauf bekommen.
Im Gefässsystem werden die Meningokokken entweder durch ein Zusammenspiel
von bakteriziden Serumantikörpern, Komplementfaktoren und phagozytierenden
Zellen abgetötet, oder sie vermehren sich und leiten damit die bakteriämische
Phase ein. Dies hängt von Defizienzen im Abwehrsystem (keine Bildung
von bakteriziden Antikörpern, ineffizientes Komplementsystem) und
von noch unbekannten Faktoren ab.
Krankheitsbilder
Die Symptome einer systemischen Infektion erscheinen zeitgleich mit der
Meningokokkämie und gehen den Symptomen der Meningitis normalerweise
24 bis 48 h voraus. Meningokokken sind in der Lage, sich mit einer erstaunlichen
Geschwindigkeit zu vermehren; innerhalb von Stunden kann ein Patient aus
völliger Gesundheit in irreversiblem Schock und deutlicher hämorrhagischer
Diathese verfallen und sterben (fulminanter Verlauf).

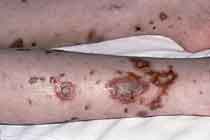
An Meningitis erkranktes Kind, Navrongo, Ghana; S. Gagneux
Hämorrhagischer Hautausschlag bei Sepsis; Wellcome Trust
Die Warnzeichen
Hirnhautentzündung ist eine seltene Krankheit. Wenn Sie jedoch an den folgenden Symptomen leiden, sollten Sie unverzüglich einen Arzt aufsuchen:
- Rasch ansteigendes und hohes Fieber
- Heftige Kopfschmerzen
- Nackensteifigkeit
(Sie können den Kopf nicht mehr Richtung Brust beugen)
Etwas später können dazukommen:
- Kleine Blutungen in der Haut, die zu kleinen, roten Flecken führen
- Das
Bewusstsein kann sich trüben
5.
Epidemiologie
top
Meningokokkeninfektionen treten in den entwickelten Ländern gehäuft
in den Winter- und Frühlingsmonaten auf. Die Übertragung erfolgt
durch Tröpfcheninfektion, der Mensch ist das einzige Erregerreservoir.
Infektionsquellen sind asymptomatische Keimträger und Erkrankte.
In den entwickelten Ländern tritt die Erkrankung zumeist sporadisch
oder in Form von Kleinepidemien in mehr oder weniger geschlossenen Kollektiven
wie Rekrutenlagern auf.
In einigen Regionen der Dritten Welt kann die Erkrankung in Form von grösseren
Epidemien vorkommen. Ein Beispiel dafür ist die Situation im sogenannten
Meningitisgürtel Afrikas südlich der Sahara, wo es alle 5-10
Jahre zu grossen Epidemien kommt. Hier steigt die Inzidenz für Meningokokkenerkrankung
gegen Ende der Trockenperiode stark an und fällt mit dem Einsetzen
der Regenzeit ab. Es wird vermutet, dass extreme Hitze und die Anwesenheit
von Staub (Wüstenwind) Schleimhaut-schädigend wirkt und damit
die Empfänglichkeit gegenüber Meningokokken erhöht. In
den letzten Jahrzehnten waren Pandemien mit dem Auftreten neuer A Meningokokken-Klone
assoziiert. C Meningokokken haben meist eher lokalisierte Epidemien hervorgerufen.
In den letzten Jahren haben auch Meningokokken der Serogruppe W135 Epidemien
hervorgerufen.
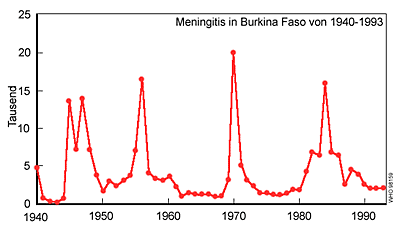
Meningitisepidemien in einem Intervall von 8-12 Jahren in Burkina Faso, einem Land im so genannten Meningitisgürtel Afrikas; G. Pluschke
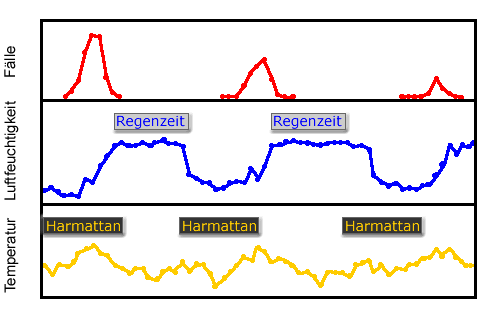
Zusammenhang zwischen saisonalen klimatischen Faktoren und dem Auftreten von Meningokokkenerkrankungen in Zaria, Nigeria, 1977-79; G. Pluschke

Staubstürme während der Trockenzeit in Westafrika; G. Pluschke
In
Europa und den USA verursachten Stämme der Serogruppe A die meisten
Ausbrüche von Meningokokkenerkrankungen in der ersten Hälfte
des 20.Jahrhunderts. Seit dem 2.Weltkrieg sind Meningokokken der Serogruppen
B und C vorherrschend. Derzeit sind Stämme der Serogruppe B für
50% aller sporadischen Fälle verantwortlich. Ausbrüche waren
zumeist mit Bakterien der Serogruppe C assoziiert. Stämme der Serogruppe
C waren für mehr Infektionen unter älteren Menschen verantwortlich,
Stämme der Serogruppe B waren vor allem bei sehr jungen Kindern häufig.
In nicht-epidemischen Zeiten liegt die allgemeine Rate an nasopharyngealen
Trägern bei deutlich mehr als 10% und kann aber in geschlossenen
Populationen wie in militärischen Ausbildungslagern oder Schulen
60% bis 80% erreichen.
Die Trägerraten sind auch unter Familienmitgliedern und anderen nahen
Kontaktpersonen eines Patienten mit Meningokokkenerkrankung hoch. Das
Trägertum besteht gewöhnlich für einige Monate; chronisches
Trägertum ist nichts aussergewöhnliches. Auf die nasopharyngeale
Besiedelung folgt ein Titeranstieg der für den besiedelnden Keim
spezifischen Serumantikörper.
Die Besiedelung führt nur selten zu einer Erkrankung. Untersuchungen
während Epidemien deuten darauf hin, dass eine invasive Meningokokkeninfektion
am wahrscheinlichsten während weniger Tage nach Eindringen eines
neuen Stammes und damit vor der Entwicklung spezifischer Antikörper
auftritt.
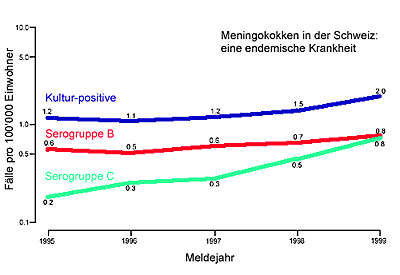
Meningitis durch Meningokokken in der Schweiz: eine endemische Krankheit. Die Serogruppen B und C dominieren; G. Pluschke
6.
Kontrollstrategien
top
Therapie
Penicillin G bleibt das Antibiotikum der Wahl bei Meningokokkenerkrankung.
Daneben spielen auch Chloramphenicol und Cephalosporine der 3. Generation
wie Ceftriaxon eine Rolle.
Prävention und Prophylaxe
In industrialisierten Ländern ist die Erkrankungshäufigkeit
unter Haushaltskontakten eines Patienten mit Meningokokkenerkrankung 100mal
höher als in der Gesamtbevölkerung. Das Risiko ist in der ersten
Woche nach Auftreten eines Infektfalles am höchsten. Eine Chemoprophylaxe
mit Rifampicin hilft, das Auftreten von weiteren Fällen zu verhindern,
und sollte bei Personen, die engen Kontakt hatten im Haushalt, Kindertagesstätten,
Kindergärten und jedem, der mit dem Infizierten oralen Kontakt (Küssen,
Mund-zu-Mund-Beatmung) hatte, verabreicht werden.
Impfung
Es sind ein bivalenter A+C Kapselpolysaccharid-Impfstoff und ein tetravalenter
Impfstoff für die Meningokokkenserogruppen A, C, W-135 und Y erhältlich.
Für die Serogruppe B gibt es keinen effektiven Impfstoff. Die Effektivität
einer Einzeldosis des Serogruppe A- oder des Serogruppe C-Impfstoffes
liegt über 90% bei Erwachsenen und bei Kindern über 2 Jahre.
Eine Routineimmunisation unter Rekruten in den USA hat die Erkrankung
bei militärischem Personal fast vollständig eliminiert. Um späte
sekundäre Fälle zu verhindern, sollten nahe Kontaktpersonen
von Patienten mit sporadischer Erkrankung, verursacht durch Stämme
der Serogruppe A oder C, eine Einmaldosis des Polysaccharid-Impfstoffes
erhalten. Menschen, die in Gegenden reisen, in denen die Erkrankung epidemisch
auftritt, sollten ebenso immunisiert werden wie auch Individuen mit Komplement-
oder Properdindefiziten oder mit Störungen der Milzfunktion. Da die
unkonjugierten Kapselpolysaccharid-Impfstoffe keine langanhaltende Immunität
hervorrufen, werden sie in Endemiegebieten wenig eingesetzt. Verbesserte
Eigenschaften haben Konjugat-Impfstoffe, bei denen Polysaccharide kovalent
an ein Carrier-Protein gebunden sind. Bislang ist jedoch lediglich ein
konjugierter Serogruppe C-Impfstoff erhältlich, der seit 1999 in
grossem Massstab in Grossbritannien eingesetzt wird. An der Entwicklung
von Serogruppe A und an polyvalenten Konjugatimpfstoffen wird gearbeitet.
Wenn diese Vakzine bei Säuglingen einen langanhaltenden Schutz schaffen,
dann könnten sie auch in routinemässigen Säuglingsimpfprogrammen
verwendet werden. Protein-basierende Serogruppe B-Impfstoffe werden ebenso
entwickelt.
7.
Kernsätze
top
- Neisseria meningitidis sind gramnegative Kokken, die den Nasopharynx des Menschen besiedeln können ohne krank zu machen.
- Der Verlauf einer Meningokokkeninfektion ist akut. Nach einer Invasion der Schleimhäute können rasch schwere Krankheitsbilder wie Sepsis ("Blutvergiftung") und Meningitis (Hirnhautentzündung) auftreten.
- Meningokokken-Infekte treten bei uns sporadisch auf, führen aber im "Meningitisgürtel" Afrikas in Intervallen von 5 bis 10 Jahren zu weitreichenden Epidemien mit Tausenden von Todesfällen.
- Als Virulenzfaktoren der Meningokokken werden diskutiert: die "Phasenvariation" (Ein - und Ausschalten bestimmter Virulenzfaktoren), Antigenvariation von Adhäsionsmolekülen (z.B. Opa), Komplementresistenz durch die Kapsel sowie IgA-Proteasen zum Schutz vor Neutralisation.
- Die Freisetzung toxischer Zellwandkomponenten (Endotoxine; z.B. Lipopolysaccharide) führen zu lebensbedrohlichen Krankheitszuständen, zum septischen Schock.
-
Vakzination, Chemotherapie und Isolierung der Krankheitsfälle sind
die gängigen Kontrollstrategien.
8.
Ressourcen
top
Lehrbuch
“Medizinische Mikrobiologie” (10. Auflage), Kayser et al.,
Thieme-Verlag: Neisseria, N. meningitidis (Seiten 284 bis 289)
Review Nreview00.pdf
Tzeng & Stephens (2000)
Epidemiology and pathogenesis of Neisseria meningitidis.
Microbes and Infection 2, 687-700
Review NVakzine02.pdf
Jodar et al. (2002)
Development of vaccines against meningococcal disease
Lancet 359, 1499-1508
Review Greenwood (1999)
Manson Lecture. Meningococcal meningitis in Africa.
Trans R Soc Trop Med Hyg 1999 Jul-Aug;93(4):341-53
This review covers the history of meningococcal meningitis in Africa since
epidemics of the infection were first described around 100 years ago.
It is possible that an epidemic strain of the meningococcus was introduced
into West Africa from the Sudan by pilgrims returning from the Haj around
the turn of the century. Since 1905 major epidemics of meningococcal meningitis
have occurred in countries of the Sahel and sub-Sahel every few years,
culminating in a massive epidemic in which nearly 200,000 cases were reported
in 1996. Attempts to control epidemic meningococcal meningitis in Africa
by vaccination with meningococcal polysaccharide vaccines have met with
only modest success because epidemics can progress with great rapidity
and vaccination is often started too late. This situation should be improved
as a result of a recent initiative, the International Coordinating Group
(ICG), which is contributing to better surveillance in countries at risk
and ensuring that vaccine is available when needed. However, in the medium
term, the best prospect for the control of meningococcal meningitis in
Africa lies in the recent development of polysaccharide-protein conjugate
vaccines which, unlike polysaccharide vaccines, are immunogenic in the
very young, induce immunological memory and are likely to give long-lasting
protection.
Originalarbeiten:
Nimmunitaet01.pdf
Pollard & Frasch (2001)
Development of natural immunity to Neisseria meningitides.
Vaccine 19, 1327-1346
NinvasionsOpa98.pdf
Dehio et al. (1998)
The role of Neisseria Opa proteins in interaction with host cells.
Trends in Microbiology 6, 489-49