Plasmodium falciparum
Plasmodium
falciparum (Welch 1897)
D: Erreger der Malaria tropica
E: tropical malaria, malignant malaria
F: paludisme
Systematik
Stamm: Apicomplexa (Sporozoa)
Klasse: Haematozoea
Ordnung: Haemosporida
Familie: Plasmodiidae
1.
Parasit, Übertragung und Vorkommen
2. Diagnostik
3. Wirt-Parasitinteraktion
4. Infektion und Krankheit
5. Epidemiologie
6. Kontrollstrategien
7. Kernsätze
8. Ressourcen
1.
Parasit, Lebenszyklus und Verbreitung
top
1. 1 Parasit
Bei
Plasmodium falciparum handelt es sich um den bedeutungsvollsten Einzeller
der Tropen: den Erreger der tödlichen Malaria tropica! Er hat im
Gegensatz zu Giardia einen indirekten Lebenszyklus: Seine Endwirte sind
Stechmücken (Anopheles-Arten) aus der Familie der Culicidae. Beim
Menschen entwickelt sich der Erreger mit ungeschlechtlichen Fortpflanzungszyklen
in der Leber (= exoerythrozytäre Schizogonie) und in den roten Blutkörperchen
(= erythrozytäre Schizogonie). Die Apicomplexa besitzen spezielle
Organellen ("Apikalorgan"), die bei Invasionsprozessen eine
wichtige Rolle spielen, ohne die der komplexe Lebenszyklus nie durchlaufen
werden könnte!
Die Genomgrösse beträgt ca. 30 Mio. Basenpaare und man schätzt,
dass die 14 Chromosomen 6000 bis 7000 Gene tragen.

Weibliche Anophelesmücke beim Blutmahl: Endwirt von Plasmodium falciparum; F. Weyer
1.2.
Lebenszyklus
Animation
Lebenszyklus
Nach
der Aufnahme von sexuell differenzierten Gamonten mit dem Blutmahl verwandeln
sich diese Formen im Darm der Mücke in Gameten. Nach der Befruchtung
des Makrogameten entwickelt sich aus der Zygote der längliche Ookinet
(Grösse: 18 x 3 µm). Ookineten verlassen das Darmlumen und
dringen in das Mitteldarmepithel ein. Dort beginnt die Sporogonie mit
einer Reduktionsteilung. Darauf entwickeln sich grosse Oozysten an der
Darmaussenseite, die bis zu 10'000 (ca. 15 µm lange) Sporozoiten
enthalten. Bricht die Oozyste auf, so gelangen die Sporozoiten in die
Hämolymphe der Mücke. Darauf wird die Speicheldrüse von
den Sporozoiten befallen. Sind Sporozoiten im Speichelausführgang
angelangt, ist die Mücke für den Menschen infektiös geworden.
Dies ist frühestens 8 Tage nach der Infektion der Fall.
Die injizierten Sporozoiten befallen nach wenigen Minuten Hepatozyten
der Leber. Dort verwandelt sich der Parasit in eine Gewebsform (Trophozoit),
beginnt mit multiplen Kernteilungen und vergrössert sich zum Leberschizonten
(40-60 µm), der mehrere Tausend Kerne enthalten kann. Darauf werden
aus Kernen und Zytoplasma neue Formen, die Merozoiten, "gebastelt".
Nach der Leberschizogonie (bei P. falciparum nur ein Zyklus im Gegensatz
zu anderen Plasmodien-Arten) befallen die Merozoiten rote Blutzellen.
Bei der aktiven Invasion (innert ca. 20 Sekunden) spielen wiederum die
apikalen Organellen eine wichtige Rolle. Die Merozoiten (bei P. falciparum
können auch mehrere pro Wirtszelle eindringen) wandeln sich in junge
Trophozoiten, so genannte Ringstadien, um. Durch Entwicklung und Wachstum
entstehen Schizonten mit 8 bis 32 Kernen. Die rote Blutzelle platzt, dabei
kommt es zu Fieber; die Inkubationszeit beträgt mindestens 9, meist
12-14 Tage, selten auch länger. Es werden Merozoiten ausgeschwemmt,
die wiederum neue Erythrozyten befallen können. Nur Erythrozyten
mit jungen Trophozoiten sind bei der tropischen Malaria — im Gegensatz
zu anderen Malaria-Arten — im peripheren Blut zu finden. Alle Wirtszellen
mit weiter entwickelten Stadien sind wegen der Sequestrierung (Bindung
an Endothelzellen der Blutkapillaren) versteckt und entgehen damit der
Zerstörung in der Milz.
Nach mehreren Wochen der erythrozytären Schizogonie entstehen die
ersten Mikro- und Makrogamonten, welche die infektiösen Stadien für
den Endwirt, die Anophelesmücke, darstellen.
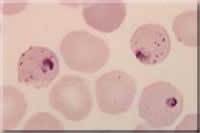 |
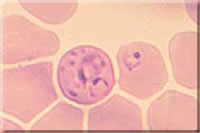 |
|||||||||||||||
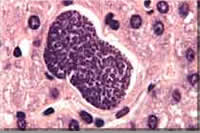 |
||||||||||||||||
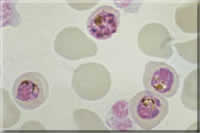 |
 |
 |
||||||||||||||
 |
 |
 |
||||||||||||||
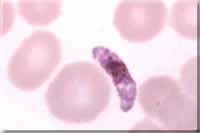
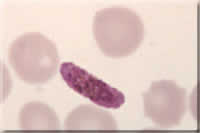
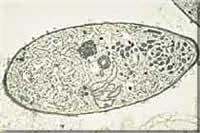
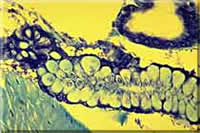
Fotos verschiedener Lebensstadien von Plasmodium; Endriss, Stöckli, Marti, Guggenheim, Hablützel, STI
1.3.
Verbreitung
Die
Malaria ist in über 100 Ländern der tropischen und subtropischen
Zonen der Erde endemisch. 2,4 Mrd. Menschen leben in ihrem Verbreitungsgebiet.
Die Malaria war noch bis vor 100 Jahren auch in Europa ein Problem, und
Plasmodium vivax kam früher sogar am Oberrhein vor!
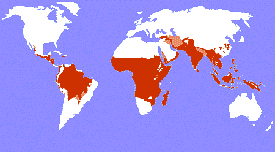
Vorkommen der tropischen Malaria
2.
Diagnostik
top
Die klassische Methode ist die mikroskopische Untersuchung von peripherem Blut (mit Giemsa gefärbter „Dicker Tropfen“ und Ausstrich). Der direkte Erregernachweis setzt gut geschultes Personal voraus! Er ist bei uns die Methode der Wahl, um eine importierte Malaria zu diagnostizieren. Auch in Gebieten mit „instabiler“ Malaria (Näheres unter 5.2.) ist der Erregernachweis sehr wichtig. Dies im Gegensatz zu holoendemischen Gebieten, in Gebieten mit „stabiler“ Malaria, wo Parasitämien asymptomatisch verlaufen können.
Neuere Methoden (sogenannte „Schnelltests“) erlauben eine indirekte Diagnose durch den Nachweis von zirkulierenden Parasiten-Antigenen im Blut. Diese werden – etwa in Kambodscha – im Feld verwendet. Bei schwachen Parasitämien können allerdings falsch-negative Resultate auftreten. Solche können jedoch auch mit dem direkten Erregernachweis auftreten, wie Paralleluntersuchungen mit dem Nachweis von Parasiten-DNS (mittels Polymerasenkettenreaktion) gezeigt haben.
Um die Endemizität der Malaria in einem bestimmten Gebiet zu bestimmen, werden folgende Methoden eingesetzt:
- Nachweis der Erreger im Blutausstrich
- Schnelltests
- Palpation des Abdomens (Milzvergrösserung)
- Untersuchung des Serums auf zirkulierende Antigene (Serumprävalenz)
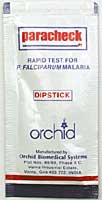
3.
Wirt-Parasitinteraktionen
top
Spezielle Aspekte im Überblick:
3.1 Invasionsstrategien von Plasmodien
3.2 Evasionsstrategien von Plasmodien
3.3 Cross-talk zwischen Plasmodien und dem Wirt
3.4 Wirt baut langsam eine klinische Immunität auf
3.1 Invasionsstrategien von Plasmodien
Der
Lebenszyklus von P. falciparum ist hoch komplex mit einer Vielzahl verschiedener
Lebensstadien, die entweder extra- oder intrazelluläre Lokalisation
haben. Extrazelluläre Stadien (Ookinet, Sporozoit und Merozoit) haben
die „Lizenz zur Invasion“! Grundlage zum Befall von geeigneten
Wirtszellen ist deren spezifische Erkennung. Diese beruht auf Rezeptor-Ligandsystemen,
bei welchen Oberflächenmoleküle des Parasiten mit Molekülen
auf der Wirtszellmembran interagieren. Nach der Adhärenz des Parasiten
an die Wirtszelle erfolgt deren Invasion. Um die Invasion zu gewährleisten,
haben die Plasmodien (oder genereller die Apicomplexa) in zellbiologische
Innovationen investiert. Ein sogenanntes Apikalorgan mit speziellen Organellen
(Mikronemen und Rhoptrien) wurde im Laufe der Evolution entwickelt.
Interessant ist, dass die Invasionsstrategien der verschiedenen Lebensstadien
unterschiedlich sind:
- Ookineten dringen – ohne die Bildung einer parasitophoren Vakuole – in Mitteldarmzellen ein und können in Nachbarzellen weiterwandern. Die befallenen Wirtszellen sterben ab, was aber kein Problem für die Mücke darstellt, weil der Zellverbund bestehen bleibt und neue Zellen nachgeliefert werden. Die Basalmembran stellt jedoch für Ookineten eine unüberwindliche Barriere dar: Die Oozyste scheint sich nach der Interaktion mit extrazellulärer Matrix zu bilden.
- Sporozoiten haben im Gegensatz zu den Ookineten die Fähigkeit, die Basalmembranen zu überwinden. Die Invasionsstrategie der Sporozoiten ist ebenfalls unterschiedlich: Bei der Invasion der Speicheldrüsenzellen wird vorübergehend eine Vakuole gebildet, an welche sich Mitochondrien anlagern. Bevor der Parasit in die Sekrethöhle eindringt, ist er frei im Zytoplasma.
- Merozoiten haben sich spezialisiert, rote Blutzellen zu befallen. Nach einer ersten Kontaktnahme reorientiert sich der Parasit und richtet seinen Apikalorgan-Pol gegen die Wirtszellmembran. Darauf erfolgt eine enge Adhärenz zwischen Parasit und Wirtszelle. Beim Invaginationsprozess, der durch aktive Bewegung des Merozoiten unterstützt wird, werden Substanzen aus den Rhoptrien und Mikronemen freigesetzt. Die Membran der sich bildenden parasitophoren Vakuole ist wahrscheinlich ein Produkt dieser Sekrete und der Wirtszellmembran.
3.2
Evasionsstrategien von Plasmodien
Das
Hauptziel des Malaria Erregers ist sein Überleben im Wirt zur Sicherung
seiner Fortpflanzung und Übertragung. Plasmodien scheinen wahre Meister
zu sein, eine Eliminierung durch das Immunsystem des Wirtes zu verhindern,
und haben eine ganze Palette an Mechanismen entwickelt. Die Sporozoiten
tragen ein Oberflächenprotein (Circumsporozoiten-Protein, CSP), welches
sich hauptsächlich aus Repeat-Einheiten zusammensetzt. Diese Repeats
werden als Superantigene angesehen, die dafür verantwortlich gemacht
werden, dass kein ausreichendes immunologisches Gedächtnis entsteht.
Zudem weist das CSP auch einen hohen Grad an Polymorphismus auf, der zum
einen jeweils eine neue Immunantwort auslöst, oder aber zur klassischen
'antigenic sin' führen kann, bei der das Immunsystem ständig
verwandte, aber ineffiziente Antikörper produziert.
Ihren nächsten Zielort, die Leberzelle, haben Plasmodien ebenfalls geschickt gewählt, da Leberzellen nur eine geringe Dichte an HLA Molekülen besitzen und immunologisch eher träge sind. Auch hier scheint Polymorphismus eine Rolle zu spielen, da offensichtlich die Immunantwort stark HLA-restringiert ist, d.h. nur bestimmte Epitope können von bestimmten HLA Molekülen erkannt werden.
Für ihre Reise durch die Blutbahn steht den Plasmodien noch eine weitere Palette an Evasionstrategien zur Verfügung: Antigendiversität, Antigenvariation, Induktion von blockierenden Antikörpern u.a.
- Antigendiversität der polymorphen Oberflächen-Proteinen (u.a. MSP1, MSP2), die ebenfalls aus Repeat-Einheiten bestehen, wird mitverantwortlich gemacht, dass sich eine schützende Immunantwort erst nach vielen Infektionen langsam aufbaut. Auch hier scheint selbst nach langjähriger Exposition keine ausreichendes Gedächtnis ausgelöst zu werden.
- Antigenvariation ist eine weitere Facette des Evasionsrepertoires der Blutstadien von Plasmodien. Für ihre Entwicklung (Schizogonie) im Erythrozyten wird die Wirtszelle vom Parasiten „neu eingerichtet“! Dabei wird auch die Wirtszellmembran verändert, um den trophischen Ansprüchen der Plasmodien gerecht zu werden. Ein spezielles Parasitenantigen, das P. falciparum Erythrozyten-Membranprotein (PfEMP1) führt zum Verkleben von infizierten Erythrozyten mit dem Endothel der Blutkapillaren (Zytoadhärenz). Diese „Sequestration“ verhindert den Durchfluss und damit die Elimination infizierter Erythrozyten durch die Milz. Jedoch macht sich der Parasit nun für das Immunsystem bemerkbar: es wird eine Immunantwort gegen PfEMP1 ausgelöst! Der Parasit jedoch entgeht der Elimination durch Umschalten auf ein anderes Gen, welches für ein antigenisch und vermutlich funktionell unterschiedliches Protein kodiert. P. falciparum besitzt etwa 50 verschiedene Gene per Genom für PfEMP1 (var-Gene). So entgeht er nicht nur der Eliminierung, sondern hat auch eine breite und diverse Palette an Molekülen zur Verfügung, sich an viele Endothel-Rezeptoren (ICAM-1, CD36, CSA, u.a.) binden zu können. Diese Bindung an Endothelzellen wird inzwischen als der Hauptvirulenzfaktor bei P. falciparum-Malaria angesehen, da diese Interaktion weitere, starke immunologische und krankmachende Reaktionen auszulösen scheint (siehe auch 3.3).
- Die Bildung von blockierenden Antikörpern ist eine weitere Strategie der Evasion. Gewisse Antikörper gegen bestimmte Epitope auf einem Antigen blockieren die Wirkung von schützenden Antikörpern, welche z.B. die Invasion des Parasiten in Wirtszellen verhindern. Dies ist am eindeutigsten für das Merozoiten-Oberflächen-Protein 1(MSP1) gezeigt worden: Seren von Malaria infizierten Probanden inhibieren die Wirkung von schützenden monoklonalen Antikörpern in vitro!
3.3 Cross-Talk zwischen Plasmodien und Wirt
Mehr
und mehr zeigt es sich, dass Wirt-Parasitbeziehungen auf sehr komplexen
gegenseitigen Beeinflussungen beruhen und die einfache Formel „Angriff
des Parasiten – Abwehr durch den Wirt“ nicht stimmt. Parasiten
sind in der Lage in das Signalsystem des Wirtes einzugreifen und dieses
zu beeinflussen. Dabei können sich Rezeptoren des Wirtes mit Signalmolekülen
der Parasiten und auch umgekehrt Parasitenrezeptoren durch Signalmoleküle
des Wirtes „miteinander sprechen“. Vor allem bei Viren und
Bakterien sind solche „Gespräche“ belegt. Aber auch bei
Plasmodien sind erste „Gesprächsnotizen“ aufgenommen.
Dabei gilt es vorsichtig zu sein, weil dieses „Abhören“
in vitro stattgefunden hat!
Die unter 3.2 beschriebene Zytoadhärenz von infizierten Erythrozyten
beschränkt sich nicht nur auf Endothelzellen, sondern wurde auch
mit Monozyten und Dendritischen Zellen (DZ) beobachtet. Diese Interaktion
scheint weitreichende Folgen für die Entwicklung unreifer DZ zu haben:
ihre Reifung wird beeinträchtigt und damit ihre Fähigkeit T-Lymphozyten
zu stimulieren. Dieser cross-talk könnte also zu der nachgewiesenen
Immundepression bei der Malaria beitragen. Nehmen Makrophagen infizierte
Erythrozyten auf, so werden deren Funktionen stark beeinträchtigt.
Dies mag u.a. auf das Malaria-Pigment (Hämozoin) zurückzuführen
sein, welches die Generation von Superoxid-Radikalen stört.
3.4
Wirt baut nur langsam eine Semi-Immunität auf
In
Endemiegebieten baut sich bei angemessener Exposition über Jahre
ein Immunschutz gegen die Malaria auf. Dabei bleibt der Mensch aber infiziert.
Es kommt nicht zu einer "sterilisierenden", sondern zu einer
"klinischen Immunität" oder Semi-Immunität. Die Effektormechanismen,
die dabei eine Rolle spielen, kennen wir trotz intensiver Forschungsarbeit
ebenso wenig wie die auslösenden Antigene. Auch sind wir den Plasmodien
noch nicht auf die Schliche gekommen, wie sie das Immunsystem erfolgreich
austricksen (vgl. unter 3.2).
4.
Infektion und Krankheit
top
Das
Spektrum der Malaria reicht von einer klinisch nicht manifesten Infektion
über nicht-lebensbedrohende Malaria-Anfällen (Episoden), schwerer,
lebensbedrohender Malaria mit zerebralen und/oder systemischen Manifestationen
(Organversagen, Anämie) bis hin zum Tod.
Die Determinanten der Übergänge von einfachen Episoden zu schweren,
lebensbedrohenden Anfällen sind nicht klar. Sie sind in der Interaktion
zwischen Infektion/Ko-Infektion, Immunität und Ernährung zu
suchen. Unbehandelt kann jede P. falciparum-Episode zum Tod führen.
Die bei der Lysis der Erythrozyten freigesetzten Endotoxine können
eine Kaskade von Zytokin-vermittelten Folgeerscheinungen auslösen,
welche zu Fieber und unter Umständen zu zerebraler Malaria und Anämie
führen könnten.
Vielleicht erinnern Sie sich noch an das Lernmodul 7 von „Parasitologie und Parasitismus“. Dort haben wir die Hintergründe des Malaria-Fiebers kurz besprochen, das auf einen „cross-talk“ zwischen Parasit und Wirt zurückgeht:
Bei der Ruptur der infizierten Erythrozyten mit reifen Blutstadien werden lösliche Toxine (vor allem Phospholipide) freigesetzt, welche Makrophagen aktivieren und zu einer Zytokinausschüttung veranlassen. Bei diesen Zytokinen handelt es sich in erster Linie um Interleukin-1 (IL-1) und Tumornekrosefaktor (TNF)-alpha, welche eine Fieberreaktion auslösen können. Reifen nun Plasmodien synchron, so kommt es zum typischen Wechselfieber. Dies ist aber wegen asynchroner Mehrfachinfektionen oft nicht der Fall. Das induzierte Fieber ist jedoch nicht nur krankmachend, sondern hat auch einen hemmenden Effekt auf die Parasitenvermehrung! Höhere Konzentrationen von TNF-alpha schädigen den Parasiten, haben aber auch eine Wirkung auf das Endothel: Die Expression von Adhäsinen (z.B. ICAM-1) wird aufreguliert, was zu einer besseren Zytoadhärenz führen kann.
5.
Epidemiologie
top
5.1 Statistiken
- Gut zwei Milliarden Menschen leben in Gebieten, wo die Gefahr besteht, dass sie durch Mückenstiche mit Malariaerregern infiziert werden.
- Jedes Jahr werden zwischen 200 und 500 Millionen neue Krankheitsfälle gemeldet und 1-2 Millionen Menschen, vor allem Kinder, sterben jährlich an Malaria.
- Damit gehen jedes Jahr gut 37 Millionen gesunde Lebensjahre (DALYs; disability adjusted life years) verloren.
- 90% der Malariabürde entfallen auf Kinder in Afrika südlich der Sahara, d.h. die meisten Todes- und Krankheitsfälle sind in den hochendemischen Gebieten Afrikas zu verzeichnen.
- Malaria ist in vielen Ländern für gut 30-50% der Gesamtlast im Gesundheitssystem verantwortlich.
- Jährlich werden rund 12’000 Malariafälle in Europa (davon 300 in der Schweiz) und 1’000 in den USA durch Reisende importiert.
5.2 Determinanten und Verlauf
- Die Endemielage hängt von der Exposition gegenüber infektiösen Stichen ab; gemessen durch die EIR („entomological inoculation rate“ = Anzahl infektiöser Stiche pro Person und Jahr).
- Die Grundreproduktionsrate der Malaria (Ro) ist mit 1000-3000 rund 100-200 mal höher als die einer viralen oder bakteriellen Infektion!
- In hochendemischen Gebieten liegt die EIR zwischen 50-400, was dazu führt, dass ein Kind bereits als Säugling hohen Stechraten ausgesetzt ist. Überlebt das Kind diese ersten Episoden durch rechtzeitige Behandlung, so entwickelt sich rasch eine Semi-Immunität, d.h. Kinder und Erwachsene der Endemiegebiete sind infiziert, aber werden nicht oder kaum mehr krank. Die Malariainfektion verläuft bei guter Semi-Immunität asymptomatisch. Die hohe Sterberate in hochendemischen Gebieten ist somit bei den Säuglingen und Kleinkindern (<5 Jahre) zu verzeichnen.
- In niederendemischen Gebieten kann eine Semi-Immunität nicht aufgebaut werden, und somit sind alle Altersklassen gleichermassen dem Risiko zu erkranken ausgesetzt.
- Epidemisch bezeichnet man die Malaria in nicht- oder niederendemischen Gebieten, wenn Fälle gehäuft und weit über das bekannte Mass auftreten, sei es als Folge von ungewöhnlich grossen Mückenpopulationen (z.B. nach Flutkatastrophen) oder neu eingewanderte, den Parasiten mit tragende Menschen (Flüchtlinge). In Hochendemiegebieten können Epidemien durch eingewanderte, nicht infizierte Menschen (Flüchtlinge; z.B. Ruander in tansanischen Flüchtlingslagern 1994) hervorgerufen werden.
- Grundsätzlich wird zwischen „stabiler“ und „instabiler“ Malaria unterschieden, die auf Grund der häufig gestellten Fragen charakterisiert werden können:
|
"Stabile", endemische Malaria |
"instabile" epidemische Malaria |
|
| Wer ist betroffen? |
Säuglinge und Kinder < 5 Jahre; ältere Kinder und Erwachsene haben durch die kontinuierliche Exposition eine Semi-Immunität erworben |
Alle Altersgruppen; vor allem auch von schweren Verlaufsformen, keine Entwicklung der Semi-Immunität |
| Wann tritt Malaria auf? |
Oft ganzjährig oder saisonal (Regenzeit) |
Oft nicht vorhanden oder mit sehr, sehr kleiner Prävalenz, jahrelang keine Fälle zu verzeichnen |
| Was wird getan? |
Da Malaria häufig asymptomatisch verläuft (Semi-Immunität), werden nur symptomatische Fälle behandelt. Ziel ist es die Morbidität zu verhindern. |
Jeder Nachweis von Parasiten wird als pathologisch betrachtet und behandelt. Ziel ist die Infektionsbehandlung und damit verhindern der Letalität |
| Kann die Übertragung unterbrochen werden? |
Grundsätzlich nein – eine Kombination von Kontrollstrategien kann die Übertragung senken |
Ja, bei genauer Kenntnis der Determinanten der Übertragung und gezieltem Einsatz von Massnahmen |

Orte stabiler und instabiler Malaria in Afrika
Quelle: www.mara.org.za
Die WHO unterscheidet heute die folgenden acht epidemiologischen Zonen für Malaria. Sie sind stets das Resultat der Interaktionen der folgenden Faktoren:
- Ökologie & Klima
- Demographie der Bevölkerung
- Sozio-ökonomische und kulturelle Charakteristika der Bevölkerungen
- Art der vorherrschenden Überträger und der Parasiten und auch deren Resistenzlage gegenüber Insektiziden resp. Medikamenten
- Struktur & Funktion des Gesundheitswesens / Versorgung
- Struktur und Art der vorhandenen Entwicklungsprojekte
Die acht epidemiologischen Zonen sind:
| Zone | Spezifische Merkmale |
| 1. Malaria in den Savannen Afrikas |
|
| 2. Randzonenmalaria |
|
| 3. Waldzonenmalaria |
|
| 4. Malaria in trad. Landwirtschaftszonen ausserhalb Afrikas |
|
| 5. Malaria im Rahmen von Entwicklungsprogrammen |
|
| 6. Malaria in Städten |
|
| 7. Malaria der Küsten- und Sumpfgebiete |
|
| 8. Kriegszonenmalaria |
|
5.3 Molekulare Epidemiologie
Molekulare
Epidemiologie bei Malaria beruht auf genetischen Unterschieden zwischen
den Wirtsindividuen einerseits und zwischen einzelnen P. falciparum-Klonen
andererseits, die beide die Morbidität und Mortalität bei einer
Infektion beeinflussen (Virulenzfaktoren). Im Zentrum der Molekularen
Epidemiologie steht also der Polymorphismus in Marker-, Virulenz- oder
Suszeptibilitätsgenen.
Die Methoden der molekularen Epidemiologie haben es erlaubt, den Unterschied zwischen Semi-Immunität und Prämunität zu erfassen:
- Semi-Immunität widerspiegelt die erworbene Immunität auf Grund von kontinuierlicher Exposition und überlebter Malariaepisoden. Sie wird auch als klinische Immunität bezeichnet.
- Prämunität charakterisiert die Immunität gegen Re- und Superinfektion, der durch im Menschen überlebenden Genotypen.
Die
in der Molekularen Epidemiologie eingesetzten Techniken müssen möglichst
robust und kostengünstig sein, da viele Studien in grösseren
Bevölkerungsgruppen durchgeführt werden. Es gibt eine Reihe
von "Hochdurchsatz"-tauglichen Genotypisierungstechniken für
die Identifizierung genetischer Unterschiede, die neben dem "Gold"
Referenzstandard (Sequenzierung) gebräuchlich sind: z.B. PCR-Grössenpolymorphismus,
MLST (multilocus sequence typing), PCR-RFLP (PCR-restriction fragment
length polymorphism), RAPD (random amplified polymorphic DNA), DNA Microarrays.
Jede dieser Methoden hat eine Nachweisgrenze und limitierte Anwendungsmöglichkeiten.
Ein Hauptanwendungsgebiet der Molekularen Epidemiologie besteht im "Monitoring"
von Interventionen gegen Malaria. Genotypisierung ermöglicht eine
genauere Beurteilung der Wirkung von Interventionen, wie z. B. eines Impfstoffs
oder eines neuen Medikaments. Weiterhin erlauben Genotypisierungsdaten
das Studium der Parasiten-Dynamik, Parasiten-Phylogenie und Populationsgenetik.
Genetischer Polymorphismus hat sich im Laufe der Evolution als eine Überlebensstrategie
herausgestellt. Auf der Flucht vor den Effektoren des Immunsystems werden
neue Varianten von P. falciparum Genen heraus selektioniert ("immune
evasion"). Im Gegenzug dazu hat auch beim Menschen eine Adaptation
an die Malaria stattgefunden, am deutlichsten erkennbar beim Polymorphismus
in den Molekülen der roten Blutzelle. Durch Malaria selektionierte
Wirtsfaktoren können hohe Allelfrequenzen erreichen obwohl sie zum
Teil ein Handicap für den Träger darstellen (Bsp. Sichelzellanämie).
6.
Kontrollstrategien
top
Die Bedeutung der Malaria hat für viele Menschen der Endemiegebiete zugenommen. Die “Waffen” der Bekämpfung sind stumpf geworden. Die Gründe der weiterhin hohen Endemielage und des Wiederaufflackerns von Malaria in malariafreien Gebieten sind vielschichtig. Die wichtigsten Punkte sind:
- der virtuose Zyklus der Malaria, der im Gegensatz zu Viren und Bakterien gezeichnet ist durch ungeheure sexuelle und asexuelle Vermehrungsstadien, Formenwandel und grosse genotypische Variationen sowie die unterschiedliche Übertragungsdynamik in verschiedenen Endemiegebieten aufgrund der komplexen Interaktion zwischen Mücke, Mensch und Umweltbedingungen: Malariaparasiten sind Überlebenskünstler.
- die rasche wachsende Resistenz der Anopheles-Mücken gegenüber den gebräuchlichen, wirksamen Insektiziden, insbesondere DDT,
- die rasche Ausbreitung der Resistenz der Malariaparasiten gegenüber den angewendeten Medikamenten zur Therapie und Prophylaxe,
- die Gesundheitssysteme, die in vielen Gebieten die rasche und wirksame Behandlung der Patienten nicht sichern können, da oft die peripheren Strukturen des Gesundheitssystems nicht ausgebaut sind oder nicht optimal funktionieren,
- das Fehlen eines Impfstoffes, was u.a. wiederum mit der Komplexität des Malariaparasiten zusammenhängt (s. Abschnitt 1),
-
schliesslich hat in spezifischen Situationen die stark erhöhte
Mobilität von Bevölkerungsgruppen die Malariaproblematik erhöht.
Stichworte sind dazu die krisen- und kriegsbedingten Bewegungen zum
Beispiel in Zentralafrika (Demokratische Republik Kongo, Ruanda) und
die Verstädterung, die die Endemielage verändern oder Menschen
neu dem Malariarisiko aussetzen.
Die heute wirksamsten Kontrollstrategien sind:
- Malariaepisoden frühzeitig zu erkennen und zu behandeln,
- insektizidbehandelte Mückennetze der Bevölkerung zugänglich zu machen und
- mit adaptierten Informations- und Kommunikationskampagnen die Aufmerksamkeit in den betroffenen Bevölkerungsgruppen zu fördern.
Vektorkontrolle
In
den 50er Jahren wurde von der Weltgesundheitsbehörde ein Programm
zur Eradikation der Malaria durch den Einsatz von Massenchemotherapie
(Chloroquin) und Insektenbekämpfung (DDT) lanciert. Resistenzentwicklungen
auf der Parasiten- wie auf der Mückenseite führten zusammen
mit finanziellen Problemen in vielen Gebieten zu einem Misserfolg.
Der Vektorkontrolle, sei es mit Insektiziden gegen adulte Mücken
oder mit Umweltveränderungen (z.B. Entwässerung), biologischen
Massnahmen (z.B. larvenfressende Fische) oder spezifischen Situationen
(z.B. Bewässerungssysteme), kann in spezifischen Gebieten jedoch
auch heute eine Rolle spielen.
Behandlung
von Malariaepisoden
Obwohl
die rasche Diagnose und Behandlung von Malariaepisoden die wichtigsten
Stützen jedes integrierten Bekämpfungsprogramms darstellen,
wurde die Forschung und Entwicklung von neuen Malariamedikamenten in den
letzten 10 Jahren von nahezu allen pharmazeutischen Unternehmen systematisch
abgebaut. Diese schwierige Situation scheint derzeit weitgehend überwunden:
Durch die Verbindung von privaten und öffentlichen Anstrengungen des MMV-Programm (Medicines for Malaria-Venture);
http://www.mmv.org/pages/page_main.htm
Vorhandene Präparate werden in ihrer gezielten Anwendung optimiert. Artemisinin, das aus der chinesischen Heilpflanze Artemisia annua isoliert wurde, und dessen Derivate u.a. Artemether, Artesunat und Artether, wurden weiterentwickelt und werden im asiatischen Raum gerade bei schweren, lebensbedrohenden sowie bei multiresistenten Malariafällen erfolgreich eingesetzt. Derzeit laufen breit angelegte, von der WHO überwachte Versuche, wie diese wichtigen Therapien in Afrika wirksam eingesetzt werden können. Afrika steht im Brennpunkt, da es nicht nur die grösste Malariabürde zeigt, sondern da in Afrika die Resistenz gegen das günstige Chloroquin bei 30-70% liegt; Chloroquin kann in weiten Teilen zur Behandlung nicht mehr eingesetzt werden. Ausblicke für diese schwierige Situation in Afrika bietet das Konzept der Kombinationstherapie. Damit die vorhandenen Medikamente möglichst lange wirksam bleiben, d.h. sich keine entsprechenden Resistenzen bilden, sollen bekannte, eingeführte Verbindungen mit Artemisinin-Derivaten kombiniert verwendet werden.
Expositionsprophylaxe
Konkrete
Wirkung zeigen aber sämtliche Programme, die den Einsatz von insektizidbehandelten
Mückennetzen auf Haushaltsebene propagieren. Nachdem grosse, kontrollierte
Feldversuche in Gebieten mit unterschiedlicher Endemielage gezeigt haben,
dass insektizidbehandelte Mückennetze die Morbidität und Mortalität
von Malaria zwischen 20-50% reduzieren können, steht nun eine Interventionsstrategie
zur Verfügung, die die vorhandenen Behandlungsstrategien optimal
ergänzen kann.
Kombination
von Bekämpfungsstrategien
Behandlungsstrategien
und insektizidbehandelte Mückennetze sind derzeit konkrete Ausblicke.
Sie werden jedoch nur nachhaltig ihre Wirksamkeit zeigen, wenn auch die
Gesundheitssysteme, in denen sie angewendet werden, entwickelt werden.
Unter den Gesundheitssystemen verstehen wir das Zusammenwirken sämtlicher
Anbieter im Gesundheitswesen (Regierung, NROs, Privatsektor inkl. der
traditionellen Systeme).
Impfung
Die
Hoffnung der 70er und 80er Jahre, bald über eine Impfung zu verfügen,
wurde bisher leider nicht erfüllt. Ein Impfstoff wäre höchst
willkommen und könnte als weitere wichtige Komponente in einem integrierten
Bekämpfungsprogramm eingesetzt werden. Es ist realistisch, an einen
Impfstoff zu denken, denn:
- Menschen, die in einem Endemiegebiet zahlreiche Malaria-Attacken überleben, erwerben eine Semi-Immunität;
- Die passive Übertragung von Serum semi-immuner Menschen auf nicht-immune kann nicht-immunen Menschen schützen.
-
Bestrahlte infektiöse Stadien des Malariaparasiten, Sporozoiten,
können im Menschen eine schützende Immunantwort auslösen.
Jahrelange Forschungsarbeiten waren jedoch bisher nicht von grossem Erfolg gekrönt. Wohl wurden unzählige, potentielle Antigene charakterisiert und in Tiermodellen als Impfstoffkandidaten geprüft. Die Hoffnung und künftigen Forschungsanstrengungen liegen derzeit in zwei bereits klinisch getesten Impfstoffen beim Weiterverfolgen der im Tiermodell erfolgreichen DNS-Vakzinen. Die Erfahrungen aus den klinischen Versuchen mit den ersten Malariaimpfstoffen führen uns auch dazu, die konventionelle Vorstellung der Schutzwirkung eines Impfstoffes (normalerweise verlangen wir eine Wirksamkeit > 90%) bei einem Parasiten wie Malaria aufzugeben. Die Berechnungen zeigen, dass selbst ein Impfstoff, der bloss 50% wirksam ist, bereits eine kostenwirksame Intervention darstellt, wenn die Impfung als Teil eines integrierten Programms verabreicht wird.
Reisemedizin
Die
wichtigsten prophylaktischen Massnahmen für Tropenreisende bestehen
in einer Malaria-Chemosuppression sowie einem adäquaten Expositionsschutz
(Repellentien, Kleider etc.). Bei der Malariaprophylaxe muss man darauf
achten, dass in verschiedenen Regionen der Erde Resistenzen gegen Medikamente
wie Chloroquin bestehen. Die Resistenzentwicklung gegen Chloroquin begann
bereits 1957. Heute sind resistente Plasmodien in vielen Malariagebieten
ein grosses Problem.
Fazit
Malaria
ist eine der wichtigsten Infektionskrankheiten der Menschheit und die
bedeutendste parasitäre Erkrankung. Sie stellt aufgrund der direkt
und indirekt verursachten Morbidität und Mortalität eine enorm
grosse physische, psychische und damit sozio-ökonomische Last für
die betroffenen Bevölkerungen und Staaten dar. Die Bekämpfung
der Malaria ist zugleich auch nachhaltige Armutsbekämpfung.
 |
 |
 |
| Medikamente zur Malariatherapie | Kampagne für Mückennetze | Impfversuch von Prof. Patarroyo |
7.
Kernsätze
top
- Plasmodium falciparum, der Erreger der tropischen Malaria, wird durch weibliche Anopheles-Mücken übertragen.
- Der einzige natürliche Zwischenwirt (!) ist der Mensch.
- Die Entwicklung des Parasiten im Menschen erfolgt über verschiedene extra- und intrazelluläre Parasitenstadien und stellt deshalb für das Immunsystem eine grosse Herausforderung dar.
- Parasitenpopulationen im Menschen stellen komplexe Gemische verschiedener Genotypen dar.
- Verschiedene Organellen des Apikalorgans befähigen den Erreger zur aktiven Invasion in verschiedene Wirtszellen.
- Faktoren der Pathogenese sind: Malariatoxine, die Fieber und Entzündungsreaktionen auslösen, Zytoadhärenz infizierter Erythrozyten an die Blutgefässwände, was zu Durchblutungsstörungen führen kann, und die parasiteninduzierte Zerstörung von Erythrozyten mit resultierender Blutarmut (Anämie).
- Malaria-Infektionen führen nicht zu einer sterilen Immunität. Bei lang andauernder Exposition wird langsam eine Semi-Immunität (Schutz vor schwerer Krankheit) aufgebaut.
- Die Evasionsstrategien des Parasiten vor der Wirtsabwehr sind intrazelluläre Lokalisation, Sequestrierung (vermeidet „Milzfalle“), Antigendiversität und -variation, welche das Immunsystem „verwirren“.
- Malaria ist eine der wichtigsten Infektionskrankheiten der Menschheit und die bedeutendste parasitäre Erkrankung (1 bis 2 Millionen Todesfällen pro Jahr).
- Die heutigen Kontrollstrategien zielen auf eine Reduktion der Morbidität durch die rasche Behandlung und die Expositionsprophylaxe mit Insektizid-behandelten Mückennetzen.
8.
Ressourcen
top
Lehrbuch
“Medizinische Mikrobiologie” (10. Auflage), Kayser et al.,
Thieme-Verlag,
Plasmodium (Seiten 544 bis 562)
Lernprogramm "Malaria" auf Englisch 2nd edit. (Topics in International
Health, The Wellcome Trust)
Reviews:
PEpidemiologie00.pdf
Malaria 21.1 Malaria Epidemiology
H.O. Lobel & S.P. Kachur
(Buchkapitel)
PDiagnostik01.pdf
Rapid diagnostic techniques for malaria control
C. Wangsrichanalai, Trends in Parasitology, 17, 307-309 (2001)
PEvolutionApicoplast99.pdf
Origin, targeting, and function of the apicomplexan plastid
D.S. Roos et al., Current Opinion in Microbiology, 2, 426-432 (1999)
PCytoadhaerenz00.pdf
Falciparum Malaria: Sticking up, Standing out and Out-standing
B.M. Cooke et al., Parasitology Today, 16, 416-420 (2000)
PAntigenvarianz01.pdf
Variant proteins on the surface of malaria-infected erythrocytes –
developing vaccines
P.E. Duffy et al., Trends in Parasitology, 17, 354-356 (2001)
PImmunologie00.pdf
The immunology of malaria infection
M. Plebanski & A.V.S. Hill, Current Opinion in Immunology, 12, 437-441
(2000)
PVakzine00.pdf
Malaria Vaccines
R.F. Anders & A. Saul, Parasitology Today, 16, 444-448 (2000)
Web-Informationen (Stand August 2002):
http://www.cdfound.to.it/HTML/pla1.htm
(Bilder im Atlas of Medical Parasitology der Carlo Denegri Foundation)
http://www.wehi.edu.au/MalDB-www/who.html
(Malaria Database; molekulare Infos zu Genom und Proteinen)
http://www.malaria.org/
(Malaria Foundation; Globale Initiativen zur Bekämpfung)
http://www.who.int/tdr/diseases/tryp/default.htm
(Special Programme for Research and Training in Tropical Diseases: Malaria)
Literatur:
Nachschlagewerke:
"Essential Malariology"
3rd ed., eds. H.M. Gilles & D.A. Warrell; Edward Arnold London, 1993
(in STI Bibliothek)
“Malaria: Parasite Biology, Pathogenesis, and Protection”
ed. Irwin W. Sherman
Am. Soc. for Microbiology, Washington DC, 1998 (in STI Bibliothek)
Originalarbeiten:
Marsh K. (1992): Malaria - a neglected disease? Parasitology 104, S. 53-S.
69.
Nchinda T.C. (1998): Malaria: A reemerging disease in Africa. Emerging
Infectious Diseases 4, 398-403.
Miller L.H. et al. (1994): Malaria Pathogenesis. Science 264, 1878-1883.