Schistosoma mansoni (Sambon 1907)
Stamm:
Plathelminthes (Plattwürmer)
Klasse: Trematoda (Digenea) Saugwürmer
Ordnung: Strigeidida (Strigeida)
Familie: Schistosomatidae
D:
Darmbilharziose
F: Bilharziose intestinale
E: intestinal schistosomosis (schistosomiasis)
1.
Parasit, Übertragung und Vorkommen
2. Diagnostik
3. Wirt-Parasitinteraktion
4. Infektion und Krankheit
5. Epidemiologie
6. Kontrollstrategien
7. Kernsätze
8. Ressourcen
1.
Parasit, Lebenszyklus und Verbreitung
top
1. 1. Parasit
Schistosomatidae
sind Trematoden, welche in den Blutgefässen von Wirbeltieren leben.
Wie bei Trematoden üblich haben sie als Zwischenwirt eine Wasserschnecke.
Die spezifischen Zwischenwirte für S. mansoni sind Posthornschnecken
der Gattung Biomphalaria. Die Schistosomosen oder Bilharziosen (4 weitere
Arten sind ebenfalls human-pathogen) sind wichtige Tropenkrankheiten in
über 70 Länder. Neben S. mansoni haben S. haematobium (nur in
Afrika) und S. japonicum (nur in Asien) grosse Bedeutung. Zwei weitere
Arten kommen nur lokal vor (S. intercalatum und S. mekongi). Die Weltgesundheitsbehörde
(WHO) schätzt dass heute rund 200 Millionen Menschen mit Schistosomen
infiziert sind. S. mansoni ist vor allem in Afrika und gewissen Gebieten
Südamerikas (Import durch Sklavenhandel im 19. Jahrhundert!) verbreitet.
Nur ein Teil der Infizierten ist jedoch ernsthaft erkrankt. Neben der
direkten Schädigung von Blutgefässen und Darmepithel durch migrierende
Eier spielen immunologische Prozesse bei der Krankheitsentstehung eine
Rolle. Im Besonderen sind dies Überempfindlichkeitsreaktionen gegen
Ei-Antigene. Wurmeier, welche den Weg in den Darm nicht finden, lagern
sich in der Leber (und andern Organen) ab und werden von Wirtszellen abgekapselt
(Granulombildung). Das führt zu einer Organschädigung, zu einer
Fibrose. Diese wiederum hat Durchblutungsstörungen und Pfortaderhochdruck
zur Folge.
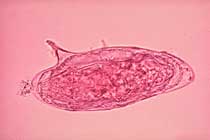
Ei von Schistosoma mansoni
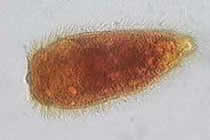
Miracidium von Schistosoma mansoni
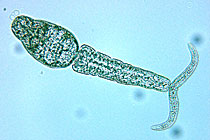
Zerkarie von Schistosoma mansoni
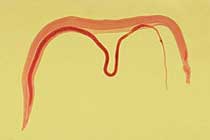
Ein Paar adulter Würmer


Biomphalaria pfeifferi, ein Zwischenwirt von Schistosoma mansoni; N. Weiss, STI
Morogoro-Region,
Tansania
Habitat von Biomphalaria pfeifferi; P. Odermatt, STI
1.2. Lebenszyklus
Die
Eier werden mit den Fezes abgegeben. Sie enthalten Wimperlarven, Mirazidien,
die sich während der Körperwanderung entwickelt haben. Auslösende
Reize für das Schlüpfen der Mirazidien im Wasser sind ein niedrigerer
osmotischer Druck (Süsswasser) und Licht. Die Mirazidien sind kurzlebig
(ca. 1 Tag lebensfähig) und müssen für ihre Weiterentwicklung
in Schnecken (beispielsweise der Gattung Biomphalaria) eindringen. Im
Zwischenwirt findet eine Entwicklung und eine un- (oder ein-?)geschlechtliche
Vermehrung statt: Eingedrungene Mirazidien wandeln sich am Penetrationsort
zu Muttersporozysten um. In den Muttersporozysten werden Tochtersporozysten
gebildet, welche in der Mitteldarmdrüse (Hepatopankreas) der Schnecke
ein krebsartiges Wachstum durchmachen und in vielen Fällen dieses
Organ zerstören. In diesen Tochtersporozysten reifen aus Keimballen
viele Zerkarien (Ruderschwanzlarven) heran. Wird eine Schnecke nur von
einem Mirazidium befallen, so entstehen nach rund einem Monat (von der
Umgebungstemperatur abhängig!) Tausende von geschlechtsdeterminierten
Zerkarien, welche die Schnecke bei Tageslicht (auch bei Vollmond!) verlassen.
Sie sind negativ geotrop, aber positiv photo- und thermotrop. Dies bringt
sie durch propellerartige Bewegung in die Nähe ihres Wirtes, dem
Menschen. Die kurzlebigen Zerkarien (ihre Glykogenreserve ist in etwa
einem Tag aufgebraucht) haften sich an der Haut an. Durch die Sekretion
von Enzymen (Kollagenase, Hyaluronidase) aus den Penetrationsdrüsen
und aktive Bewegungen dringen sie aktiv in die Haut ein. Sie werfen ihren
Ruderschwanz ab.
In der Haut baut die nun schwanzlose Zerkarie ihr Tegument um, sie wird
zum Schistosomulum. Über Lymphgefässe, venösem Blutkreislauf
über das Herz erreichen die Schistosomulae nach ca. 4 bis 10 Tagen
die Lunge. Während des Aufenthaltes in der Lunge erfolgt eine weitere
Adaptationsphase an den Wirt. Hier wird das Tegument weiter modifiziert,
und es entsteht eine bis zu siebenfache Einheitsmembran (heptalaminate
membrane) als Oberfläche, an welche verschiedene Wirtsubstanzen aufgelagert
werden. Lungen-Schistosomulae sind Komplement-resistent geworden! Die
Schistosomulae wandern gegen den Blutstrom in die Leber. Hier erfolgt
ein Längenwachstum und die weitere Entwicklung. Erst die Paarbildung
der getrenntgeschlechtlichen Würmer (Ausnahme zu den generell zwittrigen
Trematoden!) führt zur sexuellen Reifung der Pärchenegel, welche
dann in die Mesenterialvenen auswandern. Adulte Würmer haben eine
mittlere Lebenserwartung von ca. 5 Jahren.
Nach ca. 2 (- 3) Monaten (= Präpatenzzeit) lassen sich im Stuhl erste
Schistosomen-Eier nachweisen, sofern es sich nicht um eine eingeschlechtliche
Infektion handelt. Der mikroskopische Nachweis von Eiern in mehreren Stuhlproben
(wegen unregelmässiger Ausscheidung) ist die Diagnosemethode der
Wahl. Bei schwachen Infektionen (nach kurzzeitiger Exposition von Tropenreisenden)
oder während der Präpatenzzeit (ab 2- 3 Wochen nach Infektion)
lassen sich mit serologischen Methoden spezifische Antikörper im
Blut nachweisen.
Nicht alle Eier vermögen die Wanderung aus den Blutgefässen
durch Endothel und Darmepithel zu realisieren. Ein Teil der Eier wird
durch den Blutstrom in die Leber verfrachtet. Dort werden die Eier zurückgehalten
und die sezernierten "löslichen Eiantigene" (solange das
Ei ein lebensfähiges Mirazidien enthält; ca. 20 Tage) lösen
immunologische Abwehrreaktionen aus. Diese Entzündungsprozessse führen
zur Bildung eines Granuloms.
Die Eier werden unembryoniert abgelegt. Entzündungsprozesse machen
das Gewebe durchlässig, und die Eier gelangen aus den Venen in die
Darmwand. Mit der Eibildung beginnt die pathogenetisch bedeutsamste Phase.
Mehr als 50% der Eier werden über den Blutkreislauf im ganzen Körper
verteilt und bleiben in kleinen Gefässen stecken. Granulombildung.
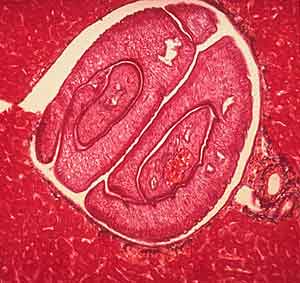
Zwei adulte Pärchenegel in einem Blutgefäss der Leber; Royal Tropical Institute, Amsterdam
1.3.
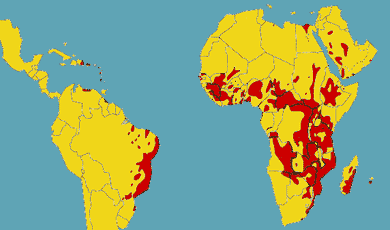
Verbreitung
Schistosoma
mansoni ist in fokalisierten Herden (natürliche und künstliche
stehende Gewässer, in Bewässerungsanlagen) in erster Linie in
Afrika südlich der Sahara und in gewissen Gebieten der südamerikanischen
Ostküste (insbesondere in Brasilien und Venezuela) und fokal auch
im Nahen Osten verbreitet.
Migrationen (Arbeitssuche, kriegerische Ereignisse) können den Parasiten
in Gebiete verschleppen, welche die entsprechenden Zwischenwirte aufweisen.
Importierte Fälle in gemässigte Zonen haben keine epidemiologische
Bedeutung, da die Zwischenwirte fehlen und keine Übertragung stattfinden
kann.
2.
Diagnostik
top
Die Methode der Wahl ist der direkte Erregernachweis durch den
mikroskopischen Nachweis der Wurmeier im Stuhl möglichst nach einer
Anreicherung. Um eine gute Empfindlichkeit zu erreichen, sollten Stuhluntersuchungen
wiederholt werden, da die Eierausscheidung starken Variationen unterliegt.
Bei schwachen Infektionen (kurzfristige Exposition bei Tropenreisenden)
oder während der Präpatenzzeit (ab 2- 3 Wochen nach Infektion)
kann eine Verdachtsdiagnose durch eine Serodiagnostik erhärtet
werden. Für die Serologie wird neben ELISA-Methoden (Immunenzym-assays)
mit Adultwurm oder Ei-Antigenen, der indirekte Immunfluoreszenztest (IFAT)
mit Zerkarien oder Gefrierschnitten adulter Würmer als Antigene eingesetzt.
Für Kontrollen nach Behandlung eignet sich die Serologie nicht, da
Antikörper über viele Jahre persistieren. Die bis heute entwickelten
Antigen-Nachweismethoden haben eine ungenügende Sensitivität.

Indirekter Immunfluoreszenztest mit Gefrierschnitt adulter Würmer;
3.
Wirt-Parasitinteraktionen
top
Das Typische der meisten Gewebshelminthosen ist ihre Chronizität.
Dank einer Modulierung des Immunsystems vermögen Makroparasiten als
"Fremdtransplantate" Jahre- bis Jahrzehnte lang zu überleben.
Es wird keine sterile Immunität aufgebaut, sondern es kann sich (wenn
überhaupt, dann nur langsam) eine Immunität gegen Reinfektionen
entwickeln. Damit kann die Wurmlast limitiert werden.
Spezielle Aspekte im Überblick:
3.1
Adaptationen des Parasiten an den Endwirt
3.2 Immunität gegen Superinfektionen ("Concomittant
immunity", Prämunität)
3.3 Wie werden Schistosomulae vom Immunsystem eliminiert?
3.4 Wie entgehen Schistosomen der Wirtsabwehr?
3.5 Die Bilharziose ist eine immunologisch bedingte
Krankheit!
3.6 Welche Faktoren beeinflussen die Wirtsempfänglichkeit?
3.1.
Adaptationen des Parasiten an den Endwirt
top
Der Vorderteil der freilebenden Zerkarie transformiert sich nach dem Eindringen
in die Haut (der Ruderschwanz wird dabei abgeworfen) zu einem Schistosomulum.
Im Gegensatz zur Zerkarie ist das Schistosomulum Wasser sensitiv, dafür
aber Komplement-resistent geworden. Wichtig dafür sind "Umbauten"
im Tegument: Es werden Mehrfachmembranen gebildet, die laufend abgegeben
und erneuert werden, im Gegensatz zu einer Einheitsmembran mit einer zum
Wasser gerichteten Glykokalyx bei den Zerkarien. Für die Entwicklung
der Schistosomulae scheint das Wirtszytokin IL-7 (es steuert die Entwicklung
von B- und T-Zellen) von Bedeutung zu sein; in IL-7 KO Mäusen ist
die Parasitenentwicklung gestört.
Nach 2 bis 3 Tagen wandern die Schistosomulae gegen den Blutstrom in die
Lunge, wo weitere Adaptationsschritte unter hoher Sauerstoffspannung ablaufen.
Nach einer weiteren Woche dringen die Schistosomulae in die Leber vor,
wo die hauptsächliche Wachstumsphase stattfindet. Damit geschlechtsreife
Würmer entstehen können braucht es die Paarung!
3.2
Immunität gegen Superinfektionen ("Concomittant immunity",
Prämunität)
top
In Endemiegebieten werden bei 10 bis 15 jährigen Kindern die stärksten
Infektionen (mit maximalen Eizahlen im Stuhl) festgestellt. Werden Schulkinder
mit Anthelminthika behandelt und bleiben aber weiterhin exponiert, so
erreichen die jüngeren Schulkinder in wenigen Monaten die alten Ei-Ausscheidungszahlen.
Die älteren Schulkinder (über 12jährige) hingegen werden
viel weniger stark reinfiziiert. Dies wird auf eine sog. Prämunität
zurückgeführt, bei welcher junge - neu eindringende - Schistosomulae
eliminiert werden können. Dies im Gegensatz zu der bestehenden Adultwurm-Population,
die eine mittlere Lebenserwartung von 6 bis 10 Jahren haben. Die Prämunität
ist bei S. mansoni infizierten Rhesusaffen stark ausgebildet und wurde
in den 70er Jahren genauer untersucht. Weiter wird diskutiert, wieweit
hormonelle Umstellungen bei der einsetzenden Pubertät eine Rolle
spielen könnten. Für die Prämunität beim Menschen
wird spezifischen IgE-Antikörpern (im speziellen gegen Oberflächenantigene
der Schistosomulae) und eosinophilen Granulozyten eine Rolle zugeschrieben.
3.3
Wie werden Schistosomulae vom Immunsystem eliminiert?
top
Unsere Kenntnisse beruhen einerseits auf in vitro Experimenten, bei welchen
verschiedene Wirtszelltypen in Gegenwart von Immunseren mit Schistosomulae
interagieren, andrerseits auf Befunden mit Labormäusen. Sind spezifische
Antikörper gegen die Oberfläche vorhanden, so können je
nach Ak-Isotyp oder -Subklasse Wirtszellen an die Schistosomulae adhärieren.
Neben Neutrophilen Granulozyten und Makrophagen sind dies in erster Linie
Eosinophile Granulozyen, die durch Exozytose den Inhalt ihrer Grana mit
der Wurmoberfläche in Kontakt bringen. Die darin enthaltenen basischen
Proteine (u.a. MBP="major basic protein" und andere kationische
Proteine) schädigen Zellmembranen und können Schistosomulae
zerstören. Die Ak-vermittelten zellulären Abwehrmechanismen
werden als sog. ADCC-Reaktionen (Antibody-dependent cellular cytotoxicity"
) bezeichnet und spielen auch bei andern Helminthen eine wichtige Rolle.
Das grosse Zielobjekt verunmöglicht einen intrazellulären Abbau.
Die extrazellulären Prozesse schädigen aber gleichzeitig das
Wirtsgewebe! Ob und wieweit ADCC-Reaktionen in vivo eine Rolle spielen,
ist zur Zeit in Diskussion. Im Mausmodell sind auch Th1-abhängige
Eliminationsmechanismen (aktivierte Makrophagen und Bildung von NO) nachgewiesen
worden, insbesondere gegen Lungen-Schistosomulae.
3.4 Wie entgehen Schistosomen der Wirtsabwehr?
top
Über mögliche Evasionsstrategien der Schistosomen wurden in
den letzten 30 Jahren verschiedene Hypothesen aufgestellt, die mit mehr
oder weniger schlüssigen Experimenten belegt worden sind.
Folgende Evasionsstrategien werden diskutiert:
- Maskierung mit Wirtsantigenen: An den Wirt adaptierte Schistosomen lagern Wirtsantigene in ihre Oberfläche ein. Nachgewiesen wurden verschiedene Serumeiweisse, Blutgruppen-Antigene und MHC-Moleküle. Belegt wurde diese Hypothese durch Transferexperimente zwischen verschiedenen Wirtsarten. Heute ist man sich über die Schutzwirkung durch Wirtsantigene weniger sicher.
- Dauernder Tegumentwechsel: Laufend werden die Wurmoberfläche erneuert und damit werden Abwehrmoleküle neutralisiert. Ausserdem können interagierende Antikörper durch sezernierte Enzyme, welche den Fc-Teil abspalten unschädlich gemacht werden.
- Modulierung der Immunantwort: Die Schistosomen beeinflussen dank ihrer dauernden Antigenstimulation und der Sekretion von immunmodulierende Substanzen die Wirksamkeit des Immunsystems. Kürzlich konnte gezeigt werden, dass vom Parasiten stammendes Prostaglandin D2 die Wanderung von Langerhans Zellen in den drainierenden Lymphknoten verhindert. Morphin- und Codein-ähnliche Moleküle werden von Schistosomen sezerniert. Diese Opiate haben hemmende Wirkung auf verschiedene Zellen der Wirtsabwehr: Sie hemmen die Phagozytosefähigkeit der Makrophagen, hemmen die Antikörper-Produktion von B-Zellen, die Zytotoxizität von NK-Zellen wie auch die Th1 Immunantwort.
3.5
Die Bilharziose ist eine immunologisch bedingte Krankheit!
top
Für die Pathogenese am wichtigsten sind die Schistosomen-Eier. Einerseits
schädigen die aus den Gefässen austretenden Eier das Wirtsgewebe
und führen dazu, dass in Stuhl (bei S. haematobium im Urin) Blut
nachgewiesen werden kann. Andrerseits induzieren die von den Miracidien
durch die Eihülle sezernierten Produkte (sog. lösliche Eiantigene;
"soluble egg antigens" SEA) eine starke Immunantwort, welche
komplexe Entzündungsreaktionen auslösen, die zur Granulombildung
um das Ei und in der Leber zu einer Fibrose führt. Leber und Milz
vergrössern sich (sog. Hepatosplenomegalie). Das geschädigte
Lebergewebe stellt eine Barriere für den Blutdurchfluss dar. Damit
kommt es zu einem Pfortader-Hochdruck und zur Ausbildung von Kollateralgefässen.
Zum Glück entwickelt sich nur bei wenigen Infizierten dieses schwere
Krankheitsbild.
Die Granulomreaktion wurde in erster Linie im Mausmodell untersucht. Schon bald war klar, dass ohne T-Zellen (insbesondere CD4-pos. T-Zellen) kein Granulom entstehen kann. Bei SCID-Mäuse mit schwerer Immundefizienz ohne funktionelle T-Zellen kommt es - anstelle von Granulomen - zu Nekrosen und schwerer Leberschädigung. Die Prozesse der Granulombildung sind hoch komplex und neben den T-Lymphozyten (zuerst Th1-, dann starke Th2-Reaktivität) spielen auch Eosinophile Granulozyten (u.a. ihre Produktion von IL-4) eine Rolle. Die zur Verfügung stehenden Mausstamme mit spezifischen Gendefekten ("Knock-out", KO-Mäuse) erlauben eine detaillierte Abklärung. Bei IL-4 KO-Mäusen entstehen jedoch ebenfalls Granulome in der Leber. Damit konnte gezeigt werden, dass auch das IL-13 (ein mit IL-4 vergleichbares Th2 Zytokin) eine wichtige Rolle bei der Granulombildung spielt. Ein interessanter Nebenbefund bei den IL-4 KO-Mäusen lag in nicht-hämorrhagischen Läsionen im Darmepithel. Es scheint, dass Entzündungsprozesse die Migration von Eiern in den Darm erleichtern. In diesem Zusammenhang interessant: Bei HIV-Infizierten werden weniger Eier im Stuhl nachgewiesen!
Allerdings können wir die Befunde des Mausmodells nicht ohne weiteres auf den Menschen beziehen. Diskrepanzen liegen in verschiedenen Aspekten:
- Genetische Diversität (Mausmodell mit Inzuchtstämmen)
- Koinfektionen beim Menschen - Pathogenfreiheit bei der Maus
-
Einmalige Infektion bei der Maus - Meist mehrfache Infektionen beim
Menschen
Wurmlast: 1 Wurmpaar bei der Maus entspräche mengenmässig 5000 Wurmpaaren beim Menschen - Kinder oft mit intra-uteriner Exposition - Versuchstiere stammen von nicht infizierten Müttern
Näher beim Menschen ist sicher das Pavianmodell. Die Hundsaffen sind natürliche Wirte und haben ein mit dem Menschen eher vergleichbares Immunsystem. Nur vorübergehend ist eine vorherrschende Th2-Immunantwort beim Pavian wie auch beim Menschen nachzuweisen. Die Immunantwort ist eine Mischung von Th1 und Th2. Beim Menschen werden Th2-Immunantworten (vor allem IgE und gewisse IgG Antikörper) als protektiv angesehen. Bei Th2-induzierten Antworten entstehen zuerst aber sog. blockierende Antikörper (u.a. IgM/IgG2 bei der Maus, beim Menschen IgG4), welche nicht protektiv sind. Damit wird der verzögerte Aufbau der Prämunität begründet. Th1-Immunantworten sind entzündungsfördernd und werden als krankmachend angesehen. So lassen sich hohe TNF-alpha Werte (als Ausdruck einer Th1-Antwort) bei schweren hepatosplenischen Krankheitsbildern nachweisen. Eine ausgewogene Th1/Th2 Immunantwort wäre beim Menschen als optimal anzusehen, wobei eine vorherrschende Th2-Antwort eine eher krankmachende Th1-Antwort in Schach halten könnte.
Die durch chronische Helminthosen induzierten Th2-Immunantworten können aber auch ihre gute Seite haben: allergische Krankheiten sind bei verwurmten Menschen weniger häufig. Als mögliche Erklärung wird die polyklonale Stimulation von zum Grossteil irrelevanten IgE-Antikörpern angeführt, welche die Bindungsstellen auf Mastzellen besetzen. Damit können spezifische Allergene keine Wirkung entfalten. Eine noch nicht geprüfte Hypothese weist regulatorischen T-Zellen (sog. Th3-Zellen), welche anti-inflammatorische Zytokine wie IL-10 und TGF-beta abgeben, eine Rolle zu.
3.6
Welche Faktoren beeinflussen die Wirtsempfänglichkeit?
top
Neuere genetische Studien weisen auf zwei Genloci hin, welche die Empfänglichkeit
gegenüber S. mansoni Infektionen mitbestimmen:
- Sm1
Lokus auf Chromosom 5 (q31-q33)
Diese Genregion kodiert für Zytokine und Zytokinrezeptoren, welche für die Entwicklung von Th2-Helferzellen nötig sind. Die höhere Empfänglichkeit wird mit einer reduzierten Entwicklungsfähigkeit von Th2 Lymphozyten assoziiert. Der gleiche Lokus scheint auch bei der Kontrolle der Malaria-Parasitämie eine Rolle zu spielen. -
Sm2 Lokus auf Chromosom 6 (q22-q23)
Dieser Lokus ist mit dem IFN-gamma Rezeptor1 Gen verlinkt. IFN-gamma ist ein Zytokin, das starke anti-Fibrose Aktivität hat. Dieser Lokus könnte über eine mögliche Regulation von IFN-gamma die Krankheitsentwicklung beeinflussen.
4.
Infektion und Krankheit
top
Die
Infektion des Endwirtes erfolgt durch Kontakt mit Oberflächenwasser,
das lebensfähige Zerkarien enthält, welche sich aktiv in die
Haut des Menschen einbohren. Zu diesen Wasserkontakten kommt es durch
verschiedene Tätigkeiten (wie fischen, Wasser holen, Wäsche
waschen oder baden).
Das Eindringen der Zerkarien kann unter Umständen zu Juckreiz und
Hautveränderungen führen. Dies ist die Regel bei Zerkarien von
nicht-humanen Schistosomatiden (u.a. S. bovis, Trichobilharzia spp.) der
Fall (Zerkariendermatitis, "swimmer's itch"). Fälle von
Zerkariendermatitis treten in den Sommermonaten (bei Temperaturen, welche
die Entwicklung der Trematoden im Zwischenwirt erlaubt) auch nach Baden
in Schweizer Seen auf.
Bei einem Teil der Infizierten (insbesondere bei manchen neuinfizierten
Tropenreisenden) kann es nach ca. 1 bis 2 Monaten nach Infestation (das
z.T. vor dem direkten Erregernachweis) zu akuten Beschwerden, dem sogenannten
Katayama-Syndrom kommen: es handelt sich um schwere allergische Krankheitsbilder
(mit Fieber, Kopf- und Gliederschmerzen, Bronchitis und weiteren Krankheitszeichen).
Typisch für dieses Syndrom ist eine Hypereosinophilie des Blutbildes.
Schistosomen-Antigene führen zur Bildung von Antikörpern und
in der Folge zu Immunkomplexen, die in den Nieren Glomerulopathien auslösen
können. Dies alles geschieht in der Regel in der Präpatenzzeit.
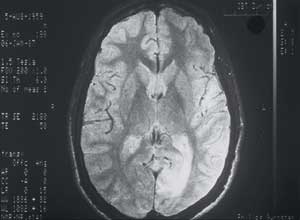
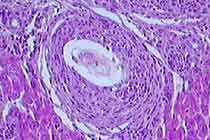
Granulom mit Ei im Zentrum;
CT des Gehirns mit Läsionen, verursacht durch Granulome von Schistosoma mansoni. Diese Granulome werden durch Eier verursacht; STI
5.
Epidemiologie
top
Die geographische Verbreitung der Bilharziose wird durch das Vorkommen
der übertragenden Wasserschnecken bestimmt. Durch die Errichtung
von Stauseen und Bewässerungsanlagen haben sich in den letzten Jahrzehnten
in Afrika neue Schneckenhabitate ausgebildet, welche zur Verbreitung der
Krankheit beitragen.
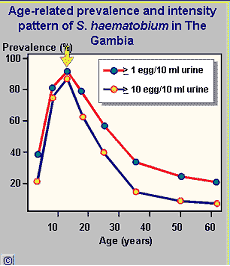
Die am stärksten betroffene Bevölkerungsgruppe sind die jüngeren
Schulkinder. Der hohe Wasserkontakt (beim Spielen) und die noch ungenügende
Prämunität führen zu hoher Wurmlast und hoher Ei-Produktion.
Durch migrierende Bevölkerungsgruppen (Nomaden,
Arbeitssuchende, Flüchtlinge) können Schistosomen weiterverbreitet
werden.
6.
Kontrollstrategien
top
Die einzusetzenden Kontrollmethoden müssen der epidemiologischen Situation, den zur Verfügung stehenden Ressourcen, dem Stand des Gesundheitswesens und sozialen Faktoren der betroffenen Bevölkerung (Brauchtum, Religion etc.) angepasst werden. Die heutigen Kontrollprojekte setzen auf eine Morbiditätsverminderung und nicht mehr auf eine Eradikation der Bilharziose.
Folgende Kontrollmassnahmen sind grundsätzlich denkbar:
-
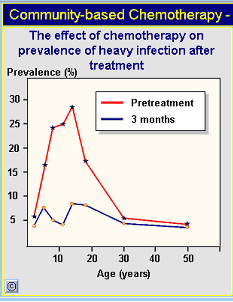
Massenchemotherapie: Das Mittel der Wahl für die Therapie der Darmbilharziose ist Praziquantel. Seine gute Verträglichkeit und gute Wirksamkeit erlaubt die Behandlung von ganzen Bevölkerungsgruppen. Allerdings sterben nicht alle Würmer ab und eine Neuinfektion wird durch das Medikament nicht verhindert. Wegen der hohen Kosten werden oft nur die Risikogruppen (Schulkinder, gewisse Berufsgruppen) in bekannten Schistosomenherden behandelt. Bei hoher Endemizität sind jährliche Wiederholungen der Chemotherapie nötig. Diese Massnahme hat nur wenig Einfluss auf die Prävalenz der Krankheit, senkt aber die Parasitenlast erheblich, was zu einer verringerten Morbidität führt.

Projekt Mangoky auf Madagaskar: Behandlung mit Ambilhar™; N. Weiss
- Artemether
zur Kontrolle der Bilharziose:
Die Wirkung von Artemisinin gegen Schistosomen der Art S. japonicum
haben chinesische Wissenschafter im Jahre 1980 beschrieben. In den letzten
Jahren haben wir am Schweizerischen Tropeninstitut in Zusammenarbeit
mit Prof. Xiao diese Untersuchungen auf S. mansoni ausgeweitet. Artemeter
hat eine sehr gute Wirkung gegen zwei bis drei Wochen alte Schistosomulae
gezeigt, ist etwas weniger aktiv gegen adulte Würmer. Dies im Gegensatz
zu Praziquantel, welches sehr gut gegen adulte Würmer wirkt, gegen
2- bis 4wöchige Schistosomulae jedoch kaum wirksam ist. Eine Kombination
beider Medikamente hat im Tierversuch eine hohe Wirksamkeit aufgewiesen.
Orale Gaben von Artemeter bei exponierten Personen, die vorgängig
mit Praziquantel behandelt worden sind, zu einer geringeren Wurmlast
durch Reinfektion geführt.
(Für Details siehe: Utzinger et al. (2001), Int. J. Parasitology 31, 1549-1562.) - Gesundheitserziehung: Eine Aufklärung der Bevölkerung im Endemiegebiet über Infektionsrisiken und Krankheit ist eine Voraussetzung für eine Kontrolle und sollte andere Kontrollmassnahmen begleiten.
- Verbesserte Wasserversorgung: Eine sichere Wasserversorgung (u.a. Brunnen für Trinkwasser; Installationen, um Wäsche zu waschen; Bademöglichkeiten) vermindern die Exposition mit Zerkarien enthaltenem Oberflächenwasser.
- Sanitarische Einrichtungen: Die Errichtung und der regelmässige Gebrauch von Latrinen verhindert die Infektion des Zwischenwirtes.
-
Kontrolle der Zwischenwirte:
Für die Schneckenbekämpfung werden in erster Line Molluskizide
(Chemikalien, auch Pflanzenextrakte) eingesetzt. Eine biologische Bekämpfung
(durch Pathogene, Schneckenfresser oder Kompetition mit andern Schneckenarten)
ist meist wenig erfolgreich.
Die Kontrolle der Schneckenbiotope, durch Trockenlegen, Kontrolle der Vegetation (insbesondere in Bewässerungskanälen) oder Massnahmen zur Erhöhung der Fliessgeschwindigkeit sind meist zu aufwändig.

Projekt Mangoky auf Madagaskar: Bekämpfung der Schnecken mit Molluskiziden; N. Weiss
- Entwicklung einer Impfung: In Tiermodellen konnte gezeigt werden, dass durch die Injektion bestrahlter, jedoch nicht abgetöteter Zerkarien eine gute Immunität (80% Schutz) gegen Reinfektion erreicht wird. Eine solche Lebendvakzine kommt für die Anwendung beim Menschen nicht in Frage. Leider haben die bis heute getesteten gentechnisch hergestellten Antigene meist nur eine schwache protektive Wirkung erzielt.
7.
Kernsätze
top
- Schistosoma mansoni ist ein humanpathogener Trematode mit einem indirekten (zweiwirtigen) Lebenszyklus. Zwischenwirte sind Posthornschnecken.
- Die Darmbilharziose (Schistosomose) ist eine Gewebshelminthose: Adulte Würmer leben in den Mesenterialvenen, die Eier gelangen in das Darmlumen oder verbleiben in Körper (vor allem im Darmepithel und in der Leber).
- Die Wurmeier verursachen in erster Linie die Krankheit; einerseits durch mechanische Schädigung bei ihrer Wanderung aus den Blutgefässen, andrerseits durch die Induktion immunologischer krankmachender Prozesse (Granulombildung).
- Unser Immunsystem kann im Laufe der Infestation langsam eine Immunität gegen Superinfektionen ("concomitant immunity") aufbauen und so die Wurmlast limitieren. Hierbei scheinen in erster Linie Eosinophile Granulozyten und spezifische Antikörper eine wichtige Rolle zu spielen.
8.
Ressourcen
top
Lehrbuch
“Medizinische Mikrobiologie” (10. Auflage), Kayser et al.,
Thieme-Verlag: Trematoda, Schistosoma (Seiten 571-579)
Salzet et al. (2000): Molecular Crosstalk in Host-Parasite relationships.
Parasitology Today 16, 536
Lernprogramm "Schistosomiasis" auf Englisch (Topics in International
Health, The Wellcome Trust